Τι είναι η διάσπαση άλφα και η βήτα διάσπαση; Διάσπαση βήτα, διάσπαση άλφα: τύποι και αντιδράσεις. Τύποι πυρηνικών μετασχηματισμών, διάσπαση άλφα και βήτα Διαφορά μεταξύ σταθερών και ασταθών πυρήνων
1. ΦΥΣΙΚΗ ΤΟΥ ΑΤΟΜΙΚΟΥ ΠΥΡΗΝΑ 1.4. β διάσπαση
1.4. Βήτα διάσπαση.
Τύποι και ιδιότητες της διάσπασης βήτα. Στοιχεία της θεωρίας της βήτα διάσπασης. Ραδιενεργές οικογένειες
Βήτα διάσπασηπυρήνας είναι η διαδικασία της αυθόρμητης μετατροπής ενός ασταθούς πυρήνα σε ισόβαρο πυρήνα ως αποτέλεσμα της εκπομπής ενός ηλεκτρονίου (ποζιτρονίου) ή της σύλληψης ενός ηλεκτρονίου. Είναι γνωστοί περίπου 900 βήτα ραδιενεργοί πυρήνες. Από αυτά, μόνο 20 είναι φυσικά, τα υπόλοιπα λαμβάνονται τεχνητά.
Τύποι και ιδιότητες της διάσπασης βήτα
Υπάρχουν τρεις τύποι β -σήψη: ηλεκτρονικός β – -διάσπαση, ποζιτρονική β + - διάσπαση και σύλληψη ηλεκτρονίων ( μι-πιάνω). Ο κύριος τύπος είναι ο πρώτος.
Στο ηλεκτρονική β – -φθοράένα από τα νετρόνια του πυρήνα μετατρέπεται σε πρωτόνιο με την εκπομπή ενός ηλεκτρονίου και ενός ηλεκτρονίου αντινετρίνο.
Παραδείγματα: διάσπαση ενός ελεύθερου νετρονίου
 , Τ 1/2 =11,7 min;
, Τ 1/2 =11,7 min;
διάσπαση τριτίου
 , Τ 1/2 = 12 χρόνια.
, Τ 1/2 = 12 χρόνια.
Στο ποζιτρόνιο β + -φθοράένα από τα πρωτόνια του πυρήνα μετατρέπεται σε νετρόνιο με την εκπομπή ενός θετικά φορτισμένου ηλεκτρονίου (ποζιτρόνιο) και ενός νετρίνου ηλεκτρονίου
 . (1.41b)
. (1.41b)
Παράδειγμα
 ·
·
Από μια σύγκριση του χρόνου ημιζωής των προγόνων των οικογενειών με τη γεωλογική διάρκεια ζωής της Γης (4,5 δισεκατομμύρια χρόνια), είναι σαφές ότι σχεδόν όλο το θόριο-232 διατηρήθηκε στην ουσία της Γης, το ουράνιο-238 αποσυντέθηκε περίπου το μισό, ουράνιο-235 - ως επί το πλείστον, ποσειδώνιο-237 σχεδόν όλο.
Σύμφωνα με τις σύγχρονες χημικές έννοιες, ένα στοιχείο είναι ένας τύπος ατόμου με το ίδιο πυρηνικό φορτίο, το οποίο αντικατοπτρίζεται στον αύξοντα αριθμό του στοιχείου στον πίνακα D.I. Μεντελέεφ. Τα ισότοπα μπορεί να διαφέρουν στον αριθμό των νετρονίων και, κατά συνέπεια, στην ατομική μάζα, αλλά δεδομένου ότι ο αριθμός των θετικά φορτισμένων σωματιδίων - πρωτονίων - είναι ο ίδιος, είναι σημαντικό να καταλάβουμε ότι μιλάμε για το ίδιο στοιχείο.
Ένα πρωτόνιο έχει μάζα 1,0073 amu. (μονάδες ατομικής μάζας) και φορτίο +1. Η μονάδα ηλεκτρικού φορτίου είναι το φορτίο ενός ηλεκτρονίου. Η μάζα ενός ηλεκτρικά ουδέτερου νετρονίου είναι 1,0087 amu. Για να ορίσετε ένα ισότοπο, είναι απαραίτητο να υποδείξετε την ατομική του μάζα, που είναι το άθροισμα όλων των πρωτονίων και των νετρονίων, και το φορτίο του πυρήνα (ο αριθμός των πρωτονίων ή, το ίδιο πράγμα, ο ατομικός αριθμός). Η ατομική μάζα, που ονομάζεται επίσης αριθμός νουκλεονίου ή νουκλεόνιο, γράφεται συνήθως στο επάνω αριστερό μέρος του συμβόλου του στοιχείου και ο ατομικός αριθμός γράφεται κάτω αριστερά.
Μια παρόμοια μορφή σημειογραφίας χρησιμοποιείται για στοιχειώδη σωματίδια. Έτσι, στις ακτίνες β, που είναι ηλεκτρόνια και έχουν αμελητέα μικρή μάζα, αποδίδεται φορτίο -1 (κάτω) και μαζικός αριθμός 0 (πάνω). Τα σωματίδια α είναι θετικά διπλά φορτισμένα ιόντα ηλίου, επομένως χαρακτηρίζονται με το σύμβολο "He" με πυρηνικό φορτίο 2 και μαζικό αριθμό 4. Οι σχετικές μάζες του πρωτονίου p n λαμβάνονται ως 1 και τα φορτία τους είναι: αντίστοιχα, 1 και 0.
Τα ισότοπα των στοιχείων συνήθως δεν έχουν ξεχωριστά ονόματα. Η μόνη εξαίρεση είναι το υδρογόνο: το ισότοπό του με αριθμό μάζας 1 είναι το πρωτίου, το 2 είναι το δευτέριο, το 3 είναι το τρίτιο. Η εισαγωγή ειδικών ονομάτων οφείλεται στο γεγονός ότι τα ισότοπα υδρογόνου διαφέρουν όσο το δυνατόν περισσότερο μεταξύ τους σε μάζα.
Ισότοπα: σταθερά και ραδιενεργά
Τα ισότοπα είναι σταθερά και ραδιενεργά. Τα πρώτα δεν υφίστανται αποσύνθεση, επομένως διατηρούνται στη φύση στην αρχική τους μορφή. Παραδείγματα σταθερών ισοτόπων είναι το οξυγόνο με ατομική μάζα 16, ο άνθρακας με ατομική μάζα 12, το φθόριο με ατομική μάζα 19. Τα περισσότερα φυσικά στοιχεία είναι ένα μείγμα πολλών σταθερών ισοτόπων.
Τύποι ραδιενεργού διάσπασης
Τα ραδιενεργά ισότοπα, φυσικά και τεχνητά, διασπώνται αυθόρμητα εκπέμποντας σωματίδια α ή β για να σχηματίσουν ένα σταθερό ισότοπο.
Μιλούν για τρεις τύπους αυθόρμητων πυρηνικών μετασχηματισμών: α-διάσπαση, β-διάσπαση και γ-διάσπαση. Κατά τη διάσπαση α, ο πυρήνας εκπέμπει ένα σωματίδιο α που αποτελείται από δύο πρωτόνια και δύο νετρόνια, με αποτέλεσμα ο μαζικός αριθμός του ισοτόπου να μειώνεται κατά 4 και το φορτίο του πυρήνα κατά 2. Για παράδειγμα, το ράδιο διασπάται σε ραδόνιο και ιόν ηλίου:
Ra(226, 88)→Rn(222, 86)+He(4, 2).
Στη βήτα διάσπαση, ένα νετρόνιο σε έναν ασταθή πυρήνα μετατρέπεται σε πρωτόνιο και ο πυρήνας εκπέμπει ένα σωματίδιο βήτα και ένα αντινετρίνο. Ο μαζικός αριθμός του ισοτόπου δεν αλλάζει, αλλά το φορτίο του πυρήνα αυξάνεται κατά 1.
Κατά τη διάσπαση γ, ο διεγερμένος πυρήνας εκπέμπει ακτινοβολία γ με μικρό μήκος κύματος. Σε αυτή την περίπτωση, η πυρηνική ενέργεια μειώνεται, αλλά το πυρηνικό φορτίο και ο αριθμός μάζας παραμένουν αμετάβλητοι.
Οι συσκευές αποθήκευσης βαρέων ιόντων ανοίγουν θεμελιωδώς νέες ευκαιρίες στη μελέτη των ιδιοτήτων των εξωτικών πυρήνων. Συγκεκριμένα, επιτρέπουν τη συσσώρευση και τη μακροχρόνια χρήση πλήρως ιονισμένων ατόμων - «γυμνών» πυρήνων. Ως αποτέλεσμα, καθίσταται δυνατή η μελέτη των ιδιοτήτων των ατομικών πυρήνων που δεν έχουν ηλεκτρονικό περιβάλλον και στους οποίους δεν υπάρχει φαινόμενο Coulomb του εξωτερικού κελύφους ηλεκτρονίων με τον ατομικό πυρήνα.
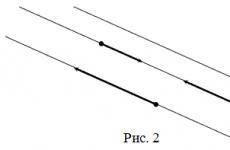
Ρύζι. 3.2 Σχέδιο ηλεκτρονικής σύλληψης σε ισότοπο (αριστερά) και πλήρως ιονισμένα άτομα και (δεξιά)
Η διάσπαση σε μια δεσμευμένη κατάσταση ενός ατόμου ανακαλύφθηκε για πρώτη φορά το 1992. Παρατηρήθηκε η β-διάσπαση ενός πλήρως ιονισμένου ατόμου σε δεσμευμένες ατομικές καταστάσεις. Ο πυρήνας 163 Dy σημειώνεται με μαύρο χρώμα στο διάγραμμα N-Z των ατομικών πυρήνων. Αυτό σημαίνει ότι είναι ένας σταθερός πυρήνας. Πράγματι, όντας μέρος ενός ουδέτερου ατόμου, ο πυρήνας 163 Dy είναι σταθερός. Η βασική του κατάσταση (5/2 +) μπορεί να κατοικηθεί ως αποτέλεσμα της e-σύλληψης από τη θεμελιώδη κατάσταση (7/2 +) του πυρήνα 163 Ho. Ο πυρήνας 163 Ho, που περιβάλλεται από ένα κέλυφος ηλεκτρονίων, είναι β - ραδιενεργός και ο χρόνος ημιζωής του είναι ~10 4 χρόνια. Ωστόσο, αυτό ισχύει μόνο εάν λάβουμε υπόψη τον πυρήνα που περιβάλλεται από ένα κέλυφος ηλεκτρονίων. Για πλήρως ιονισμένα άτομα η εικόνα είναι θεμελιωδώς διαφορετική. Τώρα η θεμελιώδης κατάσταση του πυρήνα 163 Dy είναι υψηλότερη σε ενέργεια από τη θεμελιώδη κατάσταση του πυρήνα 163 Ho και ανοίγει η πιθανότητα για τη διάσπαση του 163 Dy (Εικ. 3.2)
| → + e - + e . | (3.8) |
Το ηλεκτρόνιο που προκύπτει από τη διάσπαση μπορεί να συλληφθεί στο κενό κέλυφος K ή L του ιόντος. Ως αποτέλεσμα, η αποσύνθεση (3.8) έχει τη μορφή
→ + e - + e (σε δεσμευμένη κατάσταση).
Οι ενέργειες των β-διασπάσεων στα κελύφη K και L είναι ίσες με (50,3±1) keV και (1,7±1) keV, αντίστοιχα. Για να παρατηρηθεί η διάσπαση σε δεσμευμένες καταστάσεις του κελύφους K και L, συσσωρεύτηκαν 108 πλήρως ιονισμένοι πυρήνες στον δακτύλιο αποθήκευσης ESR στο GSI. Κατά τη διάρκεια του χρόνου συσσώρευσης, σχηματίστηκαν πυρήνες ως αποτέλεσμα της αποσύνθεσης β + (Εικ. 3.3).

Ρύζι. 3.3. Δυναμική συσσώρευσης ιόντων: α - ρεύμα ιόντων Dy 66+ που συσσωρεύτηκαν στον δακτύλιο αποθήκευσης ESR κατά τη διάρκεια διαφορετικών σταδίων του πειράματος, β- εντάσεις των ιόντων Dy 66+ και Ho 67+, μετρούμενες από εξωτερικούς και εσωτερικούς ανιχνευτές ευαίσθητους στη θέση, αντίστοιχα
Δεδομένου ότι τα ιόντα Ho 66+ έχουν πρακτικά την ίδια αναλογία M/q με τα ιόντα της κύριας δέσμης Dy 66+, συσσωρεύονται στην ίδια τροχιά. Ο χρόνος συσσώρευσης ήταν ~30 λεπτά. Για να μετρηθεί ο χρόνος ημιζωής του πυρήνα Dy 66+, η δέσμη που συσσωρεύτηκε σε τροχιά έπρεπε να καθαριστεί από την ανάμειξη ιόντων Ho 66+. Για τον καθαρισμό της δέσμης από ιόντα, ένας πίδακας αερίου αργού με πυκνότητα 6·10 12 άτομα/cm 2 και διάμετρο 3 mm εγχύθηκε στον θάλαμο, ο οποίος διέσχιζε τη συσσωρευμένη δέσμη ιόντων στην κατακόρυφη κατεύθυνση. Λόγω του γεγονότος ότι τα ιόντα Ho 66+ συνέλαβαν ηλεκτρόνια, έφυγαν από την τροχιά ισορροπίας. Η δοκός καθαρίστηκε για περίπου 500 δευτερόλεπτα. Μετά από αυτό το ρεύμα αερίου μπλοκαρίστηκε και τα ιόντα Dy 66+ και τα ιόντα Ho 66+, που σχηματίστηκαν πρόσφατα (μετά την απενεργοποίηση του ρεύματος αερίου) ως αποτέλεσμα της αποσύνθεσης, συνέχισαν να κυκλοφορούν στον δακτύλιο. Η διάρκεια αυτού του σταδίου κυμαινόταν από 10 έως 85 λεπτά. Η ανίχνευση και η ταυτοποίηση του Ho 66+ βασίστηκε στο γεγονός ότι το Ho 66+ μπορεί να ιονιστεί περαιτέρω. Για να γίνει αυτό, στο τελευταίο στάδιο, ένας πίδακας αερίου εγχύθηκε ξανά στον δακτύλιο αποθήκευσης. Το τελευταίο ηλεκτρόνιο αφαιρέθηκε από το ιόν 163 Ho 66+, με αποτέλεσμα το ιόν 163 Ho 67+. Δίπλα στον πίδακα αερίου εντοπίστηκε ένας ευαίσθητος στη θέση ανιχνευτής, ο οποίος κατέγραψε τα 163 ιόντα Ho 67+ που έφευγαν από τη δέσμη. Στο Σχ. Το Σχήμα 3.4 δείχνει την εξάρτηση του αριθμού των 163 πυρήνων Ho που σχηματίζονται ως αποτέλεσμα της β-διάσπασης από το χρόνο συσσώρευσης. Το ένθετο δείχνει τη χωρική ανάλυση του ευαίσθητου στη θέση ανιχνευτή.
Έτσι, η συσσώρευση 163 πυρήνων Ho στη δέσμη 163 Dy ήταν απόδειξη της πιθανότητας αποσύνθεσης
→ + e - + e (σε δεσμευμένη κατάσταση).

Ρύζι. 3.4. Η αναλογία θυγατρικών ιόντων 163 Ho 66+ προς πρωτεύοντα 163 Dy 66+ ανάλογα με το χρόνο συσσώρευσης. Ένθετο: κορυφή 163 Ho 67+, που καταγράφηκε από τον εσωτερικό ανιχνευτή
Μεταβάλλοντας το χρονικό διάστημα μεταξύ του καθαρισμού της δέσμης από την ακαθαρσία Ho 66+ και του χρόνου καταγραφής των ιόντων Ho 66+ που σχηματίστηκαν πρόσφατα στη δέσμη, είναι δυνατό να μετρηθεί ο χρόνος ημιζωής του πλήρως ιονισμένου ισοτόπου Dy 66+. Αποδείχθηκε ότι ήταν ίσο με ~0,1 έτος.
Μια παρόμοια διάσπαση ανακαλύφθηκε για το 187 Re 75+. Το αποτέλεσμα που προκύπτει είναι εξαιρετικά σημαντικό για την αστροφυσική. Το γεγονός είναι ότι τα ουδέτερα άτομα 187 Re έχουν χρόνο ημιζωής 4·10 10 χρόνια και χρησιμοποιούνται ως ραδιενεργά ρολόγια. Ο χρόνος ημιζωής του 187 Re 75+ είναι μόνο 33±2 χρόνια. Επομένως, είναι απαραίτητο να γίνουν κατάλληλες διορθώσεις στις αστροφυσικές μετρήσεις, γιατί Στα αστέρια, το 187 Re βρίσκεται πιο συχνά σε ιονισμένη κατάσταση.
Η μελέτη των ιδιοτήτων των πλήρως ιονισμένων ατόμων ανοίγει μια νέα κατεύθυνση έρευνας για τις εξωτικές ιδιότητες των πυρήνων, που στερούνται την επίδραση Coulomb του εξωτερικού κελύφους ηλεκτρονίων.
Σύμφωνα με τα είδη της ραδιενεργής ακτινοβολίας, υπάρχουν διάφοροι τύποι ραδιενεργού διάσπασης (τύποι ραδιενεργών μετασχηματισμών). Στοιχεία που έχουν πάρα πολλά πρωτόνια ή νετρόνια στους πυρήνες τους υφίστανται ραδιενεργό μετασχηματισμό. Ας εξετάσουμε τους τύπους ραδιενεργής διάσπασης.
1. Άλφα διάσπασηχαρακτηριστικό φυσικών ραδιενεργών στοιχείων με μεγάλο ατομικό αριθμό (δηλαδή με χαμηλές ενέργειες δέσμευσης). Είναι γνωστοί περίπου 160 άλφα-ενεργοί τύποι πυρήνων, κυρίως ο σειριακός αριθμός τους είναι μεγαλύτερος από 82 (Z > 82). Η διάσπαση άλφα συνοδεύεται από την εκπομπή από τον πυρήνα ενός ασταθούς στοιχείου ενός σωματιδίου άλφα, που είναι ο πυρήνας ενός ατόμου ηλίου He (περιέχει 2 πρωτόνια και 2 νετρόνια). Το πυρηνικό φορτίο μειώνεται κατά 2, ο μαζικός αριθμός - κατά 4.
ZAX → Z-2 A-4 U + 2 4He; 92 238U →24 He + 90 234th;
88 226Ra→2 4He + 86 222Ra + γ που εκπέμπεται.
Περισσότερο από το 10% των ραδιενεργών ισοτόπων υφίστανται διάσπαση άλφα.
2. Αποσύνθεση βήτα.Ένας αριθμός φυσικών και τεχνητών ραδιενεργών ισοτόπων υφίστανται διάσπαση, εκπέμποντας ηλεκτρόνια ή ποζιτρόνια:
α) Ηλεκτρονική βήτα διάσπαση. χαρακτηριστικό τόσο των φυσικών όσο και των τεχνητών ραδιονουκλεϊδίων που έχουν περίσσεια νετρονίων (δηλαδή, κυρίως για βαρέα ραδιενεργά ισότοπα). Περίπου το 46% όλων των ραδιενεργών ισοτόπων υφίστανται ηλεκτρονική βήτα διάσπαση. Σε αυτή την περίπτωση, ένα από τα νετρόνια μετατρέπεται σε και ο πυρήνας εκπέμπει ένα αντινετρίνο. Το φορτίο του πυρήνα και, κατά συνέπεια, ο ατομικός αριθμός του στοιχείου αυξάνεται κατά ένα, αλλά ο μαζικός αριθμός παραμένει αμετάβλητος.
AZ X → AZ+1 Y + e- + v-; 24194Pu→24195Am + e- + v-; 6429Cu → 6430Zn + e- + v-; 4019K → 4020Ca + e- + v-.
Όταν εκπέμπουν β-σωματίδια, οι ατομικοί πυρήνες μπορεί να βρίσκονται σε διεγερμένη κατάσταση όταν ανιχνεύεται περίσσεια ενέργειας στον θυγατρικό πυρήνα, ο οποίος δεν συλλαμβάνεται από σωματίδια. Αυτή η περίσσεια ενέργειας εκπέμπεται με τη μορφή ακτίνων γάμμα.
13785Cs → 13756 Ba + e -+ v- + γ εκπομπή;
β) διάσπαση βήτα ποζιτρονίων. Παρατηρείται σε ορισμένα τεχνητά ραδιενεργά ισότοπα που έχουν περίσσεια πρωτονίων στον πυρήνα. Είναι χαρακτηριστικό του 11% των ραδιενεργών ισοτόπων που βρέθηκαν στο πρώτο μισό του πίνακα του D.I. Mendeleev (Z<45). При позитронном бета-распаде один из протонов превращается в , заряд ядра и соответственно атомный номер уменьшается на единицу, а массовое число остается без изменений. Ядро испускает позитрон и нейтрино.
AZX → AZ-1У + e+ + v+; 3015P → 3014Si + e+ + v+; 6428Ni + e+ + v+.
Ένα ποζιτρόνιο, έχοντας πετάξει έξω από τον πυρήνα, αποκόπτει το «επιπλέον» από το κέλυφος του ατόμου ή αλληλεπιδρά με ένα ελεύθερο ηλεκτρόνιο, σχηματίζοντας ένα ζεύγος «ποζιτρονίων-ηλεκτρονίου», το οποίο μετατρέπεται αμέσως σε δύο κβάντα γάμμα με ισοδύναμο ενέργειας. στη μάζα των σωματιδίων (ε και ε). Η διαδικασία μετατροπής ενός ζεύγους ποζιτρονίων-ηλεκτρονίων σε δύο κβάντα γάμμα ονομάζεται εκμηδένιση (καταστροφή) και η ηλεκτρομαγνητική ακτινοβολία που προκύπτει ονομάζεται εκμηδένιση. Σε αυτή την περίπτωση, υπάρχει ένας μετασχηματισμός μιας μορφής ύλης (σωματίδια ύλης) σε μια άλλη - φωτόνια γάμμα.
γ) ηλεκτρονική σύλληψη. Αυτός είναι ένας τύπος ραδιενεργού μετασχηματισμού όταν ο πυρήνας ενός ατόμου συλλαμβάνει ένα ηλεκτρόνιο από το ενεργειακό επίπεδο Κ που βρίσκεται πιο κοντά στον πυρήνα (ηλεκτρονική σύλληψη Κ) ή, λιγότερο συχνά 100 φορές, από το επίπεδο L. Ως αποτέλεσμα, ένα από τα πρωτόνια του πυρήνα εξουδετερώνεται από ένα ηλεκτρόνιο, μετατρέποντας σε. Ο σειριακός αριθμός του νέου πυρήνα γίνεται ένα λιγότερο, αλλά ο μαζικός αριθμός δεν αλλάζει. Ο πυρήνας εκπέμπει αντινετρίνα. Ο κενός χώρος που καταλάμβανε στο επίπεδο K ή L ο συλληφθείς γεμίζει με ένα ηλεκτρόνιο από ενεργειακά επίπεδα πιο απομακρυσμένα από τον πυρήνα. Η περίσσεια ενέργειας που απελευθερώνεται κατά τη διάρκεια αυτής της μετάβασης εκπέμπεται από το άτομο με τη μορφή χαρακτηριστικής ακτινοβολίας ακτίνων Χ.
AZХ + e- → AZ-1 У + v- + ακτινοβολία ακτίνων Χ;
4019K + e- → Ar + v-+ ακτινοβολία ακτίνων Χ;
6429Сu + e- → 6428 Ni+v- + Ακτινοβολία ακτίνων Χ.
Η σύλληψη ηλεκτρονίων Κ είναι χαρακτηριστική για το 25% όλων των ραδιενεργών πυρήνων, αλλά κυρίως για τα τεχνητά ραδιενεργά ισότοπα που βρίσκονται στο άλλο μισό του πίνακα του D.I. Mendeleev και έχοντας περίσσεια πρωτονίων (Z = 45 - 105). Μόνο τρία φυσικά στοιχεία υφίστανται σύλληψη Κ: κάλιο-40, λανθάνιο-139, λουτέτιο-176 (4019K, 15957La, 17671Lu).
Μερικοί πυρήνες μπορούν να διασπαστούν με δύο ή τρεις τρόπους: με διάσπαση άλφα και βήτα και σύλληψη Κ.
Το κάλιο-40 υφίσταται, όπως έχει ήδη σημειωθεί, ηλεκτρονική διάσπαση - 88%, και σύλληψη Κ - 12%. Ο χαλκός-64 (6428Сu) μετατρέπεται σε νικέλιο (διάσπαση ποζιτρονίου - 19%, σύλληψη K - 42%; (ηλεκτρονική διάσπαση - 39%).
3. Η εκπομπή της ακτινοβολίας γ δεν είναι ένας τύπος ραδιενεργής διάσπασης (δεν υπάρχει μετασχηματισμός στοιχείων), αλλά είναι ένα ρεύμα ηλεκτρομαγνητικών κυμάτων που προκύπτουν από τη διάσπαση άλφα και βήτα των ατομικών πυρήνων (τόσο φυσικά όσο και τεχνητά ραδιενεργά ισότοπα). όταν ο θυγατρικός πυρήνας περιέχει περίσσεια ενέργειας που δεν συλλαμβάνεται από τη σωματική ακτινοβολία (σωματίδια άλφα και βήτα). Αυτή η περίσσεια φωτίζεται αμέσως με τη μορφή ακτίνων γάμμα.
13153I → 13154Xe + e- +v- +2γ κβαντικό; 22688Ra → 42He + 22286Rn + γ κβαντικό.
4. - εκπομπή πρωτονίου από τον πυρήνα στη θεμελιώδη κατάσταση. Αυτή η διαδικασία μπορεί να παρατηρηθεί σε τεχνητά παραγόμενους πυρήνες με μεγάλο έλλειμμα νετρονίων:
λουτέτιο - 151 (15171Lu) - έχει 24 λιγότερα νετρόνια από το σταθερό ισότοπο 17671Lu.