Συμπεριφορά της εντροπίας σε διαδικασίες αλλαγής κατάστασης συσσωμάτωσης. Μεταβάσεις μεταξύ καταστάσεων συνάθροισης Η μετάβαση από τη μια κατάσταση στην άλλη ονομάζεται
Η κατάσταση συσσωμάτωσης μιας ουσίας ονομάζεται συνήθως η ικανότητά της να διατηρεί το σχήμα και τον όγκο της. Ένα επιπλέον χαρακτηριστικό είναι οι μέθοδοι μετάβασης μιας ουσίας από τη μια κατάσταση συσσωμάτωσης στην άλλη. Με βάση αυτό, διακρίνονται τρεις καταστάσεις συσσωμάτωσης: στερεά, υγρή και αέρια. Οι ορατές ιδιότητές τους είναι:
Ένα συμπαγές σώμα διατηρεί τόσο σχήμα όσο και όγκο. Μπορεί να περάσει είτε σε υγρό με τήξη είτε απευθείας σε αέριο με εξάχνωση.
- Υγρό – διατηρεί όγκο, αλλά όχι σχήμα, έχει δηλαδή ρευστότητα. Το χυμένο υγρό τείνει να εξαπλώνεται απεριόριστα στην επιφάνεια στην οποία χύνεται. Ένα υγρό μπορεί να γίνει στερεό με κρυστάλλωση και αέριο με εξάτμιση.
- Αέριο – δεν διατηρεί ούτε σχήμα ούτε όγκο. Το αέριο έξω από οποιοδήποτε δοχείο τείνει να διαστέλλεται απεριόριστα προς όλες τις κατευθύνσεις. Μόνο η βαρύτητα μπορεί να τον εμποδίσει να το κάνει αυτό, λόγω της οποίας η ατμόσφαιρα της γης δεν διαχέεται στο διάστημα. Το αέριο περνά σε υγρό με συμπύκνωση και απευθείας σε στερεό με καθίζηση.
Μεταβάσεις φάσεων
Η μετάβαση μιας ουσίας από μια κατάσταση συσσωμάτωσης σε μια άλλη ονομάζεται μετάβαση φάσης, αφού η επιστημονική κατάσταση συσσωμάτωσης είναι η φάση της ύλης. Για παράδειγμα, το νερό μπορεί να υπάρχει στη στερεή φάση (πάγος), σε υγρή (απλό νερό) και σε αέρια φάση (υδροατμούς).
Το παράδειγμα του νερού είναι επίσης καλά αποδεδειγμένο. Κρεμασμένο στην αυλή για να στεγνώσει μια παγωμένη, απάνεμη μέρα, παγώνει αμέσως, αλλά μετά από λίγο καιρό αποδεικνύεται στεγνό: ο πάγος εξαχνώνεται, μετατρέποντας απευθείας σε υδρατμούς.
Κατά κανόνα, μια μετάβαση φάσης από στερεό σε υγρό και αέριο απαιτεί θέρμανση, αλλά η θερμοκρασία του μέσου δεν αυξάνεται: η θερμική ενέργεια δαπανάται για τη διάσπαση των εσωτερικών δεσμών στην ουσία. Αυτή είναι η λεγόμενη λανθάνουσα θερμότητα. Κατά τις αντίστροφες μεταβάσεις φάσης (συμπύκνωση, κρυστάλλωση), αυτή η θερμότητα απελευθερώνεται.
Αυτός είναι ο λόγος για τον οποίο τα εγκαύματα με ατμό είναι τόσο επικίνδυνα. Όταν έρχεται σε επαφή με το δέρμα, συμπυκνώνεται. Η λανθάνουσα θερμότητα της εξάτμισης/συμπύκνωσης του νερού είναι πολύ υψηλή: το νερό από αυτή την άποψη είναι μια ανώμαλη ουσία. Αυτός είναι ο λόγος για τον οποίο η ζωή στη Γη είναι δυνατή. Σε ένα έγκαυμα με ατμό, η λανθάνουσα θερμότητα της συμπύκνωσης του νερού «ζεματίζει» την καμένη περιοχή πολύ βαθιά και οι συνέπειες ενός εγκαύματος με ατμό είναι πολύ πιο σοβαρές από ό,τι από μια φλόγα στην ίδια περιοχή του σώματος.
Ψευδοφάσες
Η ρευστότητα της υγρής φάσης μιας ουσίας καθορίζεται από το ιξώδες της και το ιξώδες καθορίζεται από τη φύση των εσωτερικών δεσμών, οι οποίοι συζητούνται στην επόμενη ενότητα. Το ιξώδες του υγρού μπορεί να είναι πολύ υψηλό και τέτοιο υγρό μπορεί να ρέει απαρατήρητο από το μάτι.
Ένα κλασικό παράδειγμα είναι το γυαλί. Δεν είναι στερεό, αλλά πολύ παχύρρευστο υγρό. Λάβετε υπόψη ότι τα φύλλα γυαλιού στις αποθήκες δεν αποθηκεύονται ποτέ ακουμπισμένα διαγώνια στον τοίχο. Μέσα σε λίγες μέρες θα λυγίσουν κάτω από το βάρος τους και θα είναι ακατάλληλα για κατανάλωση.
Άλλα παραδείγματα ψευδοστερεών είναι το βερνίκι παπουτσιών και η πίσσα κατασκευών. Εάν ξεχάσετε ένα γωνιώδες κομμάτι πίσσας στη στέγη, το καλοκαίρι θα απλωθεί σε ένα κέικ και θα κολλήσει στη βάση. Τα ψευδο-στερεά σώματα διακρίνονται από τα πραγματικά από τη φύση της τήξης: τα πραγματικά είτε διατηρούν το σχήμα τους μέχρι να εξαπλωθούν αμέσως (συγκόλληση κατά τη συγκόλληση), είτε επιπλέουν, απελευθερώνοντας λακκούβες και ρυάκια (πάγος). Και τα πολύ παχύρρευστα υγρά μαλακώνουν σταδιακά, όπως η πίσσα ή η πίσσα.
Τα πλαστικά είναι εξαιρετικά παχύρρευστα υγρά, η ρευστότητα των οποίων δεν είναι αισθητή για πολλά χρόνια και δεκαετίες. Η υψηλή τους ικανότητα να διατηρούν το σχήμα τους εξασφαλίζεται από το τεράστιο μοριακό βάρος των πολυμερών, πολλές χιλιάδες και εκατομμύρια άτομα υδρογόνου.
Δομή φάσης της ύλης
Στην αέρια φάση, τα μόρια ή τα άτομα μιας ουσίας απέχουν πολύ το ένα από το άλλο, πολλές φορές μεγαλύτερη από την απόσταση μεταξύ τους. Αλληλεπιδρούν μεταξύ τους περιστασιακά και ακανόνιστα, μόνο κατά τη διάρκεια συγκρούσεων. Η ίδια η αλληλεπίδραση είναι ελαστική: συγκρούστηκαν σαν σκληρές μπάλες και αμέσως σκορπίστηκαν.
Σε ένα υγρό, τα μόρια/άτομα συνεχώς «αισθάνονται» το ένα το άλλο λόγω πολύ αδύναμων δεσμών χημικής φύσης. Αυτοί οι δεσμοί σπάνε συνεχώς και αποκαθίστανται αμέσως ξανά· τα μόρια του υγρού κινούνται συνεχώς μεταξύ τους, γι' αυτό και το υγρό ρέει. Αλλά για να το μετατρέψετε σε αέριο, πρέπει να σπάσετε όλους τους δεσμούς ταυτόχρονα, και αυτό απαιτεί πολλή ενέργεια, γι' αυτό το υγρό διατηρεί τον όγκο του.
Από αυτή την άποψη, το νερό διαφέρει από τις άλλες ουσίες στο ότι τα μόριά του στο υγρό συνδέονται με τους λεγόμενους δεσμούς υδρογόνου, οι οποίοι είναι αρκετά ισχυροί. Επομένως, το νερό μπορεί να είναι υγρό σε θερμοκρασία κανονική για τη ζωή. Πολλές ουσίες με μοριακό βάρος δεκάδες και εκατοντάδες φορές μεγαλύτερο από αυτό του νερού είναι, υπό κανονικές συνθήκες, αέρια, όπως το συνηθισμένο οικιακό αέριο.
Σε ένα στερεό, όλα τα μόριά του είναι σταθερά στη θέση τους λόγω των ισχυρών χημικών δεσμών μεταξύ τους, σχηματίζοντας ένα κρυσταλλικό πλέγμα. Οι κρύσταλλοι κανονικού σχήματος απαιτούν ειδικές συνθήκες για την ανάπτυξή τους και ως εκ τούτου είναι σπάνιοι στη φύση τους. Τα περισσότερα στερεά είναι συσσωματώματα μικρών και μικροσκοπικών κρυστάλλων - κρυσταλλίτες - που συνδέονται στενά με μηχανικές και ηλεκτρικές δυνάμεις.
Εάν ο αναγνώστης έχει δει ποτέ, για παράδειγμα, έναν ραγισμένο άξονα άξονα αυτοκινήτου ή μια σχάρα από χυτοσίδηρο, τότε οι κόκκοι κρυσταλλίτη σε σκραπ είναι ορατοί με γυμνό μάτι. Και σε θραύσματα σπασμένων πορσελάνης ή πήλινα μπορούν να παρατηρηθούν κάτω από ένα μεγεθυντικό φακό.
Πλάσμα αίματος
Οι φυσικοί εντοπίζουν επίσης μια τέταρτη κατάσταση της ύλης - το πλάσμα. Στο πλάσμα, τα ηλεκτρόνια διαχωρίζονται από τους ατομικούς πυρήνες και είναι ένα μείγμα ηλεκτρικά φορτισμένων σωματιδίων. Το πλάσμα μπορεί να είναι πολύ πυκνό. Για παράδειγμα, ένα κυβικό εκατοστό πλάσματος από το εσωτερικό των αστεριών -λευκών νάνων- ζυγίζει δεκάδες και εκατοντάδες τόνους.
Το πλάσμα απομονώνεται σε μια ξεχωριστή κατάσταση συσσωμάτωσης επειδή αλληλεπιδρά ενεργά με τα ηλεκτρομαγνητικά πεδία λόγω του γεγονότος ότι τα σωματίδια του είναι φορτισμένα. Στον ελεύθερο χώρο, το πλάσμα τείνει να διαστέλλεται, να ψύχεται και να μετατρέπεται σε αέριο. Αλλά υπό την επίδραση ηλεκτρομαγνητικών πεδίων, μπορεί να διατηρήσει το σχήμα και τον όγκο του έξω από το αγγείο, σαν ένα στερεό σώμα. Αυτή η ιδιότητα του πλάσματος χρησιμοποιείται σε αντιδραστήρες θερμοπυρηνικής ενέργειας - πρωτότυπα εργοστασίων ηλεκτροπαραγωγής του μέλλοντος.
Κάθε ουσία αποτελείται από μόρια και οι φυσικές της ιδιότητες εξαρτώνται από το πώς τα μόρια είναι ταξινομημένα και πώς αλληλεπιδρούν μεταξύ τους. Στη συνηθισμένη ζωή, παρατηρούμε τρεις αθροιστικές καταστάσεις της ύλης - στερεά, υγρή και αέρια.Ανάλογα με τη θερμοκρασία και την πίεση (συνθήκες), οι περισσότερες ουσίες μπορεί να βρίσκονται σε αέρια, υγρή ή στερεή κατάσταση, που ονομάζονται συγκεντρωτικές καταστάσεις της ύλης. Η διαφορά μεταξύ των τριών καταστάσεων συσσωμάτωσης καθορίζεται από την απόσταση μεταξύ των μορίων και τον βαθμό της αλληλεπίδρασής τους.
| Κατάσταση της ύλης | Ιδιότητες της ύλης | Απόσταση σωματιδίων | Αλληλεπίδραση σωματιδίων | Η φύση της κίνησης | Εντολή διευθέτησης |
| Αέριο | Δεν διατηρεί σχήμα ή όγκο | Πολύ μεγαλύτερο από το μέγεθος των ίδιων των σωματιδίων | Αδύναμος | Χαοτικό (ατίθασο) συνεχές. Πετάνε ελεύθερα, μερικές φορές συγκρούονται. | Ακατάστατος |
| Υγρό | Δεν διατηρεί το σχήμα, διατηρεί τον όγκο | Συγκρίσιμο με το μέγεθος των ίδιων των σωματιδίων | Ισχυρός | Ταλαντώνονται γύρω από τη θέση ισορροπίας, πηδώντας συνεχώς από το ένα μέρος στο άλλο. | Ακατάστατος |
| Στερεός | Διατηρεί σχήμα και όγκο | Μικρό σε σύγκριση με το μέγεθος των ίδιων των σωματιδίων | Πολύ δυνατός | Συνεχώς ταλαντώνεται γύρω από τη θέση ισορροπίας | Με συγκεκριμένη σειρά |
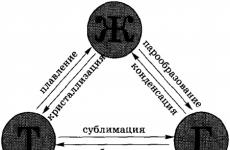
Διαδικασίες στις οποίες υπάρχει μεταβολή στις αθροιστικές καταστάσεις των ουσιών, έξι συνολικά.Η μετάβαση μιας ουσίας από στερεό σε υγρό ονομάζεται τήξη, αντίστροφη διαδικασία – αποκρυστάλλωση. Όταν μια ουσία μετατρέπεται από υγρή σε αέρια, ονομάζεται εξάτμιση, από αέριο σε υγρό – συμπύκνωση. Η μετάβαση από μια στερεά κατάσταση απευθείας σε ένα αέριο, παρακάμπτοντας την υγρή κατάσταση, ονομάζεται εξάχνιση, αντίστροφη διαδικασία – αποεξάχνωση.
· 1. Λιώσιμο
· 2. Κρυστάλλωση
· 3. Εξάτμιση
· 4. Συμπύκνωση
· 5. Εξάχνωση
· 6. Αποεξάχνωση
Παραδείγματα όλων αυτών των μεταβάσεωνΕσείς και εγώ το έχουμε δει αυτό περισσότερες από μία φορές στη ζωή μας. Ο πάγος λιώνει για να σχηματίσει νερό, το νερό εξατμίζεται για να σχηματίσει ατμό. Στην αντίθετη κατεύθυνση, ο ατμός, συμπυκνώνοντας, μετατρέπεται ξανά σε νερό και το νερό, παγώνοντας, γίνεται πάγος. Και αν νομίζετε ότι δεν γνωρίζετε τις διαδικασίες εξάχνωσης και αποεξάχνωσης, τότε μην βιαστείτε να βγάλετε συμπεράσματα. Η μυρωδιά οποιουδήποτε στερεού σώματος δεν είναι τίποτα άλλο από εξάχνωση. Μερικά μόρια διαφεύγουν από το σώμα, σχηματίζοντας ένα αέριο που μπορούμε να μυρίσουμε. Ένα παράδειγμα της αντίστροφης διαδικασίας είναι τα σχέδια στο γυαλί το χειμώνα, όταν ο ατμός στον αέρα, παγωμένος, κατακάθεται στο γυαλί και σχηματίζει παράξενα σχέδια.
Δεσμός υδρογόνου
Τι είναι ο δεσμός υδρογόνου; Ένα πολύ γνωστό παράδειγμα αυτής της σύνδεσης είναι το συνηθισμένο νερό (H2O). Επειδή το άτομο οξυγόνου (Ο) είναι πιο ηλεκτραρνητικό από τα δύο άτομα υδρογόνου (Η), απομακρύνει τα συνδετικά ηλεκτρόνια από τα άτομα υδρογόνου. Ως αποτέλεσμα της δημιουργίας ενός τέτοιου ομοιοπολικού πολικού δεσμού, σχηματίζεται ένα δίπολο. Το άτομο οξυγόνου αποκτά μικρό αρνητικό φορτίο και τα άτομα υδρογόνου αποκτούν μικρό θετικό φορτίο, το οποίο έλκεται από τα ηλεκτρόνια (το μοναδικό τους ζεύγος) στο άτομο οξυγόνου του γειτονικού μορίου H2O (δηλαδή του νερού). Έτσι, μπορούμε να πούμε ότι ένας δεσμός υδρογόνου είναι μια ελκτική δύναμη που σχηματίζεται μεταξύ ενός ατόμου υδρογόνου και ενός ηλεκτραρνητικού ατόμου. Ένα σημαντικό χαρακτηριστικό του ατόμου του υδρογόνου είναι ότι η έλξη των ηλεκτρονίων που συνδέονται με τον δεσμό του εκθέτει τον πυρήνα του (δηλαδή το πρωτόνιο, το οποίο δεν θωρακίζεται από άλλα ηλεκτρόνια). Και παρόλο που ο δεσμός υδρογόνου είναι ασθενέστερος από τον ομοιοπολικό δεσμό, είναι ακριβώς αυτό που καθορίζει μια σειρά από ανώμαλες ιδιότητες του H2O (νερό).
Τις περισσότερες φορές, αυτός ο δεσμός σχηματίζεται με τη συμμετοχή ατόμων των ακόλουθων στοιχείων: οξυγόνο (O), άζωτο (N) και φθόριο (F). Αυτό συμβαίνει επειδή τα άτομα αυτών των στοιχείων είναι μικρού μεγέθους και χαρακτηρίζονται από υψηλή ηλεκτραρνητικότητα. Με μεγαλύτερα άτομα (θείο S ή χλώριο Cl), ο σχηματιζόμενος δεσμός υδρογόνου είναι ασθενέστερος, παρά το γεγονός ότι αυτά τα στοιχεία είναι συγκρίσιμα σε ηλεκτραρνητικότητα με το Ν (δηλαδή το άζωτο).
Υπάρχουν δύο τύποι δεσμών υδρογόνου:
1.Διαμοριακός δεσμός υδρογόνου– εμφανίζεται ανάμεσα σε δύο μόρια, για παράδειγμα: μεθανόλη, αμμωνία, υδροφθόριο
2. Ενδομοριακός δεσμός υδρογόνου– εμφανίζεται μέσα σε ένα μόριο, για παράδειγμα: 2-νιτροφαινόλη.
Επί του παρόντος, πιστεύεται επίσης ότι οι χημικοί δεσμοί υδρογόνου μπορεί να είναι αδύναμοι και ισχυροί. Διαφέρουν μεταξύ τους σε ενέργεια και μήκος δεσμού (απόσταση μεταξύ ατόμων):
1. Οι δεσμοί υδρογόνου είναι αδύναμοι. Ενέργεια – 10-30 kJ/mol, μήκος δεσμού – 30. Όλες οι ουσίες που αναφέρονται παραπάνω είναι παραδείγματα κανονικών ή ασθενών δεσμών υδρογόνου.
2. Οι δεσμοί υδρογόνου είναι ισχυροί. Ενέργεια – 400 kJ/mol, μήκος – 23-24. Πειραματικά δεδομένα δείχνουν ότι σχηματίζονται ισχυροί δεσμοί στα ακόλουθα ιόντα: ιόν διφθοριούχου υδρογόνου -, ιόν ένυδρου υδροξειδίου -, ένυδρο ιόν οξωνίου +, καθώς και σε διάφορες άλλες οργανικές και ανόργανες ενώσεις.
Ανάλογα με τις συνθήκες, τα σώματα μπορεί να βρίσκονται σε υγρή, στερεή ή αέρια κατάσταση. Αυτές οι καταστάσεις ονομάζονται αθροιστικές καταστάσεις της ύλης .
Στα αέρια, η απόσταση μεταξύ των μορίων είναι πολύ μεγαλύτερη από το μέγεθος των μορίων. Εάν το αέριο δεν παρεμποδίζεται από τα τοιχώματα του δοχείου, τα μόριά του διαχωρίζονται.
Στα υγρά και τα στερεά, τα μόρια βρίσκονται πιο κοντά μεταξύ τους και επομένως δεν μπορούν να απομακρυνθούν το ένα από το άλλο.
Η μετάβαση από μια κατάσταση συνάθροισης σε μια άλλη ονομάζεται μετάβαση φάσης .
Η μετάβαση μιας ουσίας από στερεό σε υγρό ονομάζεται τήξη και η θερμοκρασία στην οποία συμβαίνει αυτό είναι σημείο τήξης . Η μετάβαση μιας ουσίας από υγρή σε στερεή κατάσταση ονομάζεται αποκρυστάλλωση , και η θερμοκρασία μετάβασης είναι θερμοκρασία κρυστάλλωσης .
Η ποσότητα θερμότητας που απελευθερώνεται κατά την κρυστάλλωση ενός σώματος ή που απορροφάται από ένα σώμα κατά την τήξη, ανά μονάδα μάζας του σώματος, ονομάζεται ειδική θερμότητα σύντηξης (κρυστάλλωση) λ:
Κατά την κρυστάλλωση, απελευθερώνεται η ίδια ποσότητα θερμότητας που απορροφάται κατά την τήξη.
Η μετάβαση μιας ουσίας από υγρή σε αέρια κατάσταση ονομάζεται εξάτμιση . Η μετάβαση μιας ουσίας από αέρια σε υγρή κατάσταση ονομάζεται συμπύκνωση . Η ποσότητα θερμότητας που απαιτείται για την εξάτμιση (που απελευθερώνεται κατά τη συμπύκνωση):
| Q = Lm, |
Η εξάτμιση που συμβαίνει από την επιφάνεια ενός υγρού ονομάζεται εξάτμιση . Η εξάτμιση μπορεί να συμβεί σε οποιαδήποτε θερμοκρασία. Η μετάβαση του υγρού σε ατμό, που συμβαίνει σε ολόκληρο τον όγκο του σώματος, ονομάζεται βρασμός και η θερμοκρασία στην οποία βράζει το υγρό είναι σημείο βρασμού .
Τελικά, εξάχνιση είναι η μετάβαση μιας ουσίας από μια στερεή κατάσταση απευθείας σε μια αέρια κατάσταση, παρακάμπτοντας το υγρό στάδιο.
Εάν άλλες παράμετροι του εξωτερικού περιβάλλοντος (κυρίως η πίεση) παραμείνουν σταθερές, τότε η θερμοκρασία του σώματος δεν αλλάζει κατά τη διαδικασία τήξης (κρυστάλλωσης) και βρασμού.
Αν ο αριθμός των μορίων που εξέρχονται από το υγρό είναι ίσος με τον αριθμό των μορίων που επιστρέφουν στο υγρό, τότε λέμε ότι έχει επέλθει δυναμική ισορροπία μεταξύ του υγρού και των ατμών του. Ο ατμός που βρίσκεται σε δυναμική ισορροπία με το υγρό του ονομάζεται
: [σε 30 τόμους] / κεφ. εκδ. A. M. Prokhorov; 1969-1978, τ. 1).
Συγκεντρωτικές καταστάσεις της ύλης(από λατ. συσσωμάτωμα- Προσθέτω) - πρόκειται για καταστάσεις της ίδιας ουσίας σε διαφορετικά διαστήματα (διαστήματα) θερμοκρασιών και πιέσεων.
Οι συγκεντρωτικές καταστάσεις θεωρούνται ότι είναι αεριώδης,υγρόΚαι σκληρά. Τα πιο απλά παραδείγματα ύπαρξης της ίδιας ουσίας σε αυτές τις τρεις συγκεντρωτικές καταστάσεις που παρατηρούνται στην καθημερινή ζωή είναι ο πάγος, το νερό και οι υδρατμοί. Αόρατοι υδρατμοί είναι πάντα παρόντες στον αέρα γύρω μας. Το νερό υπάρχει στην περιοχή θερμοκρασίας από 0 °C έως 100 °C, ο πάγος υπάρχει σε θερμοκρασίες κάτω από 0 °C. Σε θερμοκρασίες άνω των 100 ºС και κανονική ατμοσφαιρική πίεση, τα μόρια του νερού υπάρχουν μόνο σε αέρια κατάσταση - με τη μορφή υδρατμών. Το νερό, ο πάγος και οι υδρατμοί είναι η ίδια ουσία με τον χημικό τύπο H 2 O.
Παρατηρούμε πολλές ουσίες στην καθημερινή ζωή μόνο σε μία από τις καταστάσεις συσσωμάτωσης. Έτσι, το οξυγόνο στον αέρα γύρω μας είναι αέριο. Αλλά σε θερμοκρασία -193°C μετατρέπεται σε υγρό. Ψύχοντας αυτό το υγρό στους -219 ºС, λαμβάνουμε στερεό οξυγόνο. Αντίθετα, ο σίδηρος είναι στερεός υπό κανονικές συνθήκες. Ωστόσο, σε θερμοκρασία 1535 ° C, ο σίδηρος λιώνει και μετατρέπεται σε υγρό. Πάνω από το λιωμένο σίδερο θα υπάρχει αέριο - ατμός από άτομα σιδήρου.
Υπάρχουν διαφορετικές καταστάσεις συσσωμάτωσης για κάθε ουσία. Αυτές οι ουσίες διαφέρουν όχι σε μόρια, αλλά στο πώς βρίσκονται αυτά τα μόρια και πώς κινούνται. Η διάταξη των μορίων του νερού σε τρεις καταστάσεις συσσωμάτωσης φαίνεται στο σχήμα:
Μετάβαση από τη μια κατάσταση συνάθροισης στην άλλη.Κάτω από ορισμένες συνθήκες, οι ουσίες μπορούν να μετατραπούν από τη μια κατάσταση συσσωμάτωσης στην άλλη. Όλοι οι πιθανοί μετασχηματισμοί φαίνονται στο σχήμα:

Συνολικά, υπάρχουν έξι διαδικασίες στις οποίες αθροιστικούς μετασχηματισμούς της ύλης. Η μετάβαση μιας ουσίας από στερεή (κρυσταλλική) κατάσταση σε υγρή ονομάζεται τήξη αποκρυστάλλωση, ή βαφή μέταλλου. Ένα παράδειγμα τήξης είναι το λιώσιμο του πάγου· η αντίστροφη διαδικασία συμβαίνει όταν το νερό παγώνει.
Η μετάβαση μιας ουσίας από υγρή σε αέρια κατάσταση ονομάζεται εξάτμιση, ονομάζεται η αντίστροφη διαδικασία συμπύκνωση. Ένα παράδειγμα εξάτμισης είναι η εξάτμιση του νερού· η αντίστροφη διαδικασία μπορεί να παρατηρηθεί όταν πέφτει δροσιά.
Η μετάβαση μιας ουσίας από στερεή κατάσταση απευθείας σε αέρια κατάσταση (παρακάμπτοντας την υγρή κατάσταση) ονομάζεται εξάχνιση, ή εξάχνιση, ονομάζεται η αντίστροφη διαδικασία αποεξάχνωση. Για παράδειγμα, ο γραφίτης μπορεί να θερμανθεί στους χίλιους, δύο χιλιάδες ακόμη και τρεις χιλιάδες βαθμούς και, ωστόσο, δεν θα μετατραπεί σε υγρό: θα εξαχνωθεί, δηλαδή, θα μεταβεί αμέσως από μια στερεή κατάσταση σε μια αέρια κατάσταση. Ο λεγόμενος ξηρός πάγος (στερεό μονοξείδιο του άνθρακα) περνά επίσης απευθείας στην αέρια κατάσταση (παρακάμπτοντας την υγρή κατάσταση). CO 2), το οποίο μπορεί να δει κανείς σε δοχεία αποστολής παγωτού. Όλες οι οσμές που διακατέχονται από στερεά (για παράδειγμα, ναφθαλίνη) προκαλούνται επίσης από την εξάχνωση: όταν τα μόρια πετούν έξω από ένα στερεό, σχηματίζουν ένα αέριο (ή ατμό) πάνω από αυτό που έχει μια οσμή.
Ένα παράδειγμα αποεξάχνωσης είναι ο σχηματισμός μοτίβων κρυστάλλων πάγου στα παράθυρα το χειμώνα. Αυτά τα όμορφα σχέδια σχηματίζονται από την αφυδάτωση των υδρατμών στον αέρα.
Οι μεταβάσεις της ύλης από τη μια κατάσταση συσσωμάτωσης στην άλλη παίζουν σημαντικό ρόλο όχι μόνο στη φύση, αλλά και στην τεχνολογία. Έτσι, το νερό που μετατρέπεται σε ατμό μπορεί να χρησιμοποιηθεί σε ατμοστρόβιλους σε σταθμούς ηλεκτροπαραγωγής. Διάφορα κράματα λαμβάνονται από λιωμένα μέταλλα σε εργοστάσια: χάλυβας, χυτοσίδηρος, ορείχαλκος, κ.λπ. Για να κατανοήσετε αυτές τις διαδικασίες, πρέπει να γνωρίζετε τι συμβαίνει σε μια ουσία όταν αλλάζει η κατάσταση συσσώρευσής της και υπό ποιες συνθήκες είναι δυνατή αυτή η αλλαγή.