وظائف زعزعة استقرار البروتين. الطفرات المزعزعة للاستقرار تمهد الطريق للابتكار التطوري. هيكل ووظائف الحمض النووي الريبي
لقد تحدثنا حتى الآن عن مشاركة البروتينات الفردية في التكاثر كما لو أنها تعمل بشكل مستقل عن بعضها البعض. وفي الوقت نفسه، في الواقع، يتم دمج معظم هذه البروتينات في مجمع كبير يتحرك بسرعة على طول الحمض النووي وينفذ عملية النسخ بدقة عالية بشكل منسق. يُقارن هذا المجمع بـ "آلة خياطة" صغيرة: "أجزاؤها" عبارة عن بروتينات فردية، ومصدر طاقتها هو تفاعل التحلل المائي لثلاثي فوسفات النيوكليوسيد. يتم تفكيك الحلزون بواسطة مروحية الحمض النووي. يتم دعم هذه العملية بواسطة حمض توبويزوميراز الحمض النووي، الذي يعمل على فك خيوط الحمض النووي والعديد من جزيئات البروتين المزعزعة للاستقرار والتي ترتبط بكلا خيوط الحمض النووي المفردة. في منطقة الشوكة، يعمل اثنان من بوليميرات الحمض النووي - على الشريط الأمامي والمتأخر. على الشريط الرئيسي، يعمل بوليميراز الحمض النووي بشكل مستمر، وعلى الشريط المتأخر، يقاطع الإنزيم ويستأنف عمله من وقت لآخر، وذلك باستخدام بادئات الحمض النووي الريبي (RNA) القصيرة التي يتم تصنيعها بواسطة أولي الحمض النووي. يرتبط جزيء الحمض النووي الأولي مباشرة مع هيليكاز الحمض النووي، مما يشكل بنية تسمى بريموسوم. يتحرك البدائي في اتجاه فتح شوكة النسخ، وعلى طول الطريق، يقوم بتصنيع التمهيدي RNA لشظايا أوكازاكي. يتحرك بوليميريز الحمض النووي الرائد، وعلى الرغم من صعوبة تخيله للوهلة الأولى، فإن بوليميريز الحمض النووي المتأخر يتحرك في نفس الاتجاه. للقيام بذلك، يُعتقد أن الأخير يقوم بتركيب شريط الحمض النووي، الذي يعمل كقالب، على نفسه، مما يضمن دوران 180 درجة لبوليميراز الحمض النووي للشريط المتخلف. تضمن الحركة المنسقة لبوليميرات الحمض النووي التكرار المنسق لكلا الخيطين. وهكذا، فإن حوالي عشرين بروتينًا مختلفًا (قمنا بتسمية جزء منها فقط) تعمل في وقت واحد في شوكة النسخ، وتنفذ عملية معقدة ومرتبة للغاية وتستهلك الكثير من الطاقة.
الترابط بين عمليتي تكرار الحمض النووي وانقسام الخلايا
قبل كل انقسام، يجب على الخلية حقيقية النواة تصنيع نسخ من جميع كروموسوماتها. يحدث تكرار الحمض النووي لكروموسوم حقيقي النواة عن طريق تقسيم الكروموسوم إلى العديد من النسخ الفردية. لا يتم تنشيط جميع هذه النسخ المتماثلة في نفس الوقت، ولكن يجب أن يسبق انقسام الخلايا تكرار واحد إلزامي لكل منها. مما سبق، يتضح أن العديد من شوكات التضاعف يمكن أن تتحرك بشكل مستقل عن بعضها البعض على طول الكروموسوم حقيقي النواة في أي وقت محدد. ويتوقف تقدم الشوكة فقط عندما تصطدم بشوكة أخرى تتحرك في الاتجاه المعاكس، أو عندما تصل إلى نهاية الكروموسوم. ونتيجة لذلك، يتم تكرار كل الحمض النووي للكروموسوم في وقت قصير. بعد تجميع بروتينات الكروموسومات على جزيء الحمض النووي، ينقسم كل زوج من الكروموسومات بشكل منظم إلى خلايا ابنة أثناء عملية الانقسام.
الاستنتاجات
يتم تنسيق عملية تكرار الحمض النووي مع انقسام الخلايا وتتطلب العمل المشترك للعديد من البروتينات. انها مشتركة:
1. هيليكاز الحمض النووي والبروتينات المزعزعة للاستقرار؛ يقومون بفك الحلزون المزدوج للحمض النووي الأبوي وتشكيل شوكة النسخ.
2. بوليميراز الحمض النووي، الذي يحفز تخليق سلسلة بولي نيوكليوتيد الحمض النووي في الاتجاه 3 "-5"، ونسخ القالب عند شوكة النسخ بدرجة عالية من الدقة. وبما أن خيطي الحلزون المزدوج للحمض النووي متضادان، في الاتجاه 5"-3" يتم تصنيع واحدة فقط من الاثنين بشكل مستمر، بينما يتم تصنيع السلسلة الأخرى، المتأخرة، على شكل شظايا أوكازاكي قصيرة. توليف حبلا جديد.
3. DNA primase، الذي يحفز جزيئات RNA التمهيدية القصيرة. وبعد ذلك، تتم إزالة أجزاء الحمض النووي الريبي (RNA) واستبدالها بالحمض النووي (DNA).
4. التيلوميراز، الذي يكمل بناء نهايات 3 بوصات غير المتضاعفة لجزيئات الحمض النووي الخطية.
5. إنزيمات توبويزوميراز الحمض النووي والتي تساعد في حل مشاكل التواء وتشابك حلزون الحمض النووي.
6. البروتينات البادئة التي ترتبط عند أصل التضاعف وتعزز تكوين عين تضاعف جديدة بشوكة واحدة أو اثنتين. في كل من الشوكات، بعد بروتينات البدء، يتم أولاً ربط مركب بروتيني يتكون من هيليكاز الحمض النووي وبريميز الحمض النووي (بريموسوم) بالحمض النووي غير الملتوي.
ثم تضاف بروتينات أخرى إلى البدائي وتنشأ "آلة النسخ" التي تقوم بتخليق الحمض النووي.
الأدب
1. O. O. فافوروفا. الحفاظ على الحمض النووي بين السكان: تكرار الحمض النووي. مجلة سوروس التربوية، 1996
2. ج.م. ديمشيتس. مشكلة تكرار نهايات الجزيئات الخطية والتيلوميراز. مجلة سوروس التربوية، 2000
البروتينات هي اللبنات الأساسية للجسم وتشارك في عملية التمثيل الغذائي. لوظائف البروتينات في الجسم أهمية كبيرة للحفاظ على الحياة.
بناء
البروتينات عبارة عن بوليمرات حيوية تتكون من وحدات فردية - مونومرات تسمى الأحماض الأمينية. وهي تتألف من الكربوكسيل (-COOH)، ومجموعة أمين (-NH2) وجذري. ترتبط الأحماض الأمينية مع بعضها البعض باستخدام رابطة الببتيد (-C(O)NH-)، وتشكل سلسلة طويلة.
العناصر الكيميائية الأساسية للأحماض الأمينية:
- كربون؛
- هيدروجين؛
- نتروجين؛
- الأكسجين.

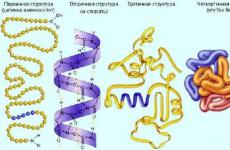
أرز. 1. هيكل البروتين.
قد يشمل الجذر الكبريت وعناصر أخرى. تختلف البروتينات ليس فقط في الجذور، ولكن أيضًا في عدد مجموعات الكربوكسيل والأمين. ونتيجة لهذا هناك ثلاثة أنواع من الأحماض الأمينية:
- محايد (-COOH و-NH2)؛
- الأساسية (-COOH وعدة -NH2)؛
- حمضية (عدة -COOH و-NH2).
وفقا للقدرة على تصنيعها داخل الجسم، يتم عزلها نوعين من الأحماض الأمينية:
أعلى 2 المقالاتالذين يقرؤون جنبا إلى جنب مع هذا
- قابلة للاستبدال - يتم تصنيعها في الجسم.
- لا يمكن الاستغناء عنه - لا يتم تصنيعه في الجسم ويجب أن يأتي من البيئة الخارجية.
حوالي 200 من الأحماض الأمينية معروفة. ومع ذلك، فإن 20 منها فقط تشارك في بناء البروتينات.
توليف
يحدث التخليق الحيوي للبروتين على ريبوسومات الشبكة الإندوبلازمية. إنها عملية معقدة تتكون من مرحلتين:
- تشكيل سلسلة ببتيد.
- تعديل البروتين.
يتم تصنيع شبكة البولي ببتيد بمساعدة المصفوفة ونقل الحمض النووي الريبي (RNA). هذه العملية تسمى الترجمة. أما المرحلة الثانية فتشمل "العمل على الأخطاء". يتم استبدال أجزاء من البروتين المركب أو إزالتها أو تمديدها.

أرز. 2. تخليق البروتين.
المهام
يتم عرض الوظائف البيولوجية للبروتينات في الجدول.
|
وظيفة |
وصف |
أمثلة |
|
ينقل |
نقل العناصر الكيميائية إلى الخلايا وإعادتها إلى البيئة الخارجية |
يحمل الهيموجلوبين الأكسجين وثاني أكسيد الكربون، والترانسكورتين هو هرمون الغدة الكظرية في الدم |
|
محرك |
يساعد على انقباض العضلات في الحيوانات متعددة الخلايا |
الأكتين، الميوسين |
|
الهيكلي |
توفير القوة للأنسجة والهياكل الخلوية |
الكولاجين، الفيبروين، البروتينات الدهنية |
|
بناء |
المشاركة في تكوين الأنسجة والأغشية وجدران الخلايا. تتكون من العضلات والشعر والأوتار |
الإيلاستين، الكيراتين |
|
الإشارة |
نقل المعلومات بين الخلايا والأنسجة والأعضاء |
السيتوكينات |
|
إنزيمي أو محفز |
معظم الإنزيمات الموجودة في جسم الحيوانات والبشر هي من أصل بروتيني. فهي محفز للعديد من التفاعلات الكيميائية الحيوية (تسريعها أو إبطائها) |
الانزيمات |
|
تنظيمية أو هرمونية |
تتحكم الهرمونات المشتقة من البروتين في عمليات التمثيل الغذائي وتنظمها |
الأنسولين، اللوتروبين، الثيروتروبين |
|
تنظيم الجينات |
تنظيم وظائف الأحماض النووية أثناء نقل المعلومات الوراثية |
تنظم الهستونات تكرار الحمض النووي ونسخه |
|
طاقة |
يستخدم كمصدر إضافي للطاقة. عندما يتفكك 1 جرام، يتحرر 17.6 كيلوجول |
تتحلل بعد استنفاد مصادر الطاقة الأخرى - الكربوهيدرات والدهون |
|
محمي |
بروتينات محددة - الأجسام المضادة - تحمي الجسم من العدوى عن طريق تدمير الجزيئات الأجنبية. بروتينات خاصة تجلط الدم وتوقف النزيف |
الغلوبولين المناعي، الفيبرينوجين، الثرومبين |
|
تخزين |
يتم تخزينها لتغذية الخلايا. يحتفظ بالمواد التي يحتاجها الجسم |
يحتفظ الفيريتين بالحديد والكازين والجلوتين والألبومين في الجسم |
|
مستقبل |
احتفظ بالمنظمات المختلفة (الهرمونات والوسطاء) على سطح الخلية أو داخلها |
مستقبل الجلوكاجون، بروتين كيناز |
يمكن أن يكون للبروتينات تأثير سام ومعادل. على سبيل المثال، تفرز عصية التسمم الغذائي سمًا من أصل بروتيني، ويرتبط بروتين الألبومين بالمعادن الثقيلة.
الانزيمات
يجدر بنا أن نقول بإيجاز عن الوظيفة التحفيزية للبروتينات. يتم تصنيف الإنزيمات أو الإنزيمات إلى مجموعة خاصة من البروتينات. يقومون بالتحفيز - تسريع التفاعل الكيميائي.
وفقا لبنيتها، يمكن أن تكون الإنزيمات:
- بسيط - تحتوي على بقايا الأحماض الأمينية فقط؛
- معقد - بالإضافة إلى بقايا مونومر البروتين، فإنها تشمل هياكل غير بروتينية تسمى العوامل المساعدة (الفيتامينات، الكاتيونات، الأنيونات).
تحتوي جزيئات الإنزيم على جزء نشط (المركز النشط) يربط البروتين بمادة - الركيزة. "يتعرف" كل إنزيم على ركيزة معينة ويرتبط بها. عادة ما يكون الموقع النشط عبارة عن "جيب" تدخل إليه الركيزة.
يتم وصف ربط الموقع النشط والركيزة بواسطة نموذج الملاءمة المستحث (نموذج القفازات اليدوية). يوضح النموذج أن الإنزيم "يتكيف" مع الركيزة. من خلال تغيير البنية، يتم تقليل طاقة ومقاومة الركيزة، مما يساعد الإنزيم على نقله بسهولة أكبر إلى المنتج.

أرز. 3. نموذج قفاز اليد.
يعتمد نشاط الإنزيم على عدة عوامل:
- درجة حرارة؛
- تركيزات الانزيم والركيزة.
- حموضة.
هناك 6 فئات من الإنزيمات، كل منها يتفاعل مع مواد معينة. على سبيل المثال، تنقل الإنزيمات الناقلة مجموعة الفوسفات من مادة إلى أخرى.
يمكن للإنزيمات تسريع التفاعلات 1000 مرة.
ماذا تعلمنا؟
لقد اكتشفنا الوظائف التي تؤديها البروتينات في الخلية، وكيفية تركيبها وكيفية تصنيعها. البروتينات عبارة عن سلاسل بوليمرية تتكون من أحماض أمينية. هناك 200 حمض أميني معروف، لكن البروتينات يمكن أن تشكل 20 فقط. يتم تصنيع بوليمرات البروتين على الريبوسومات. تؤدي البروتينات وظائف مهمة في الجسم: فهي تقوم بنقل المواد، وتسريع التفاعلات الكيميائية الحيوية، والتحكم في العمليات التي تحدث في الجسم. تربط الإنزيمات الركيزة وتنقلها بشكل مقصود إلى مواد، مما يؤدي إلى تسريع التفاعلات بمقدار 100-1000 مرة.
اختبار حول الموضوع
تقييم التقرير
متوسط تقييم: 4.6. إجمالي التقييمات المستلمة: 367.
تمكن علماء الأحياء الأمريكيون من فك رموز الآلية التطورية التي تسمح لبكتيريا لامدا بتطوير طريقة جديدة لإصابة الخلايا البكتيرية في التجارب المعملية. ينشأ الابتكار التطوري استجابةً لاكتساب البكتيريا مقاومة للنمط القديم من الهجوم الفيروسي، استنادًا إلى ارتباط البروتين الفيروسي J بالبروتين السطحي البكتيري LamB. في هذه الحالة، يعمل الانتقاء أولاً على إصلاح الطفرات الجينية ج، وتعزيز الوظيفة القديمة. "الدفع" مقابل الارتباط الأفضل بـ LamB هو زعزعة استقرار البروتين J. ونتيجة لذلك، يتم الحصول على فيروسات يمكن أن يكون فيها للبروتين J تكوينان مكانيان مختلفان لنفس الجينوم. في هذه الحالة، تصيب الجسيمات الفيروسية التي لها حرف J مطوي "بشكل صحيح" الضحايا بالطريقة القديمة، في حين أن الجسيمات الفيروسية الأخرى (التي لها نفس الجينوم، ولكن مع طية J "بشكل خاطئ") تفعل ذلك بطريقة جديدة، حيث ترتبط ببروتين سطحي آخر من الجينوم. البكتيريا (OmpF). وفي المستقبل، يمكن لكلا المتغيرين أن يستقرا عن طريق إصلاح طفرات إضافية، مما يؤدي في الواقع إلى تقسيم الفيروس الأصلي إلى نوعين. يؤكد العمل الفكرة القديمة، ولكن مع القليل من الأدلة التجريبية، التي تقول إن الوظائف الجديدة يمكن أن تتطور من خلال مرحلة متوسطة من زعزعة الاستقرار المظهري يليها تثبيت ("الاستيعاب الجيني") للانحرافات غير الوراثية الناجحة.
لقد ناقش المنظرون منذ فترة طويلة الدور المحتمل لزعزعة الاستقرار المظهري في ظهور الابتكارات التطورية. ومن المفترض أن الابتكارات يمكن أن تنشأ وفقا للمخطط التالي: " النمط الظاهري المستقر الأولي ← التأثير المزعزع للاستقرار (على سبيل المثال، تغير حاد في البيئة) ← نمو التباين غير الوراثي ← الاستيعاب الوراثي للنمط الظاهري الناجح، أي توحيد الطفرات التي تعمل على تثبيت متغير النمط الظاهري الذي تبين أنه أن تكون قابلة للتكيف في الظروف الجديدة" تم وصف هذا النموذج بالتفصيل في الأخبار زعزعة استقرار التنمية - الطريق إلى الابتكارات التطورية ("العناصر"، 13/07/2009). تبدو الفكرة منطقية، ولكن لا يزال هناك القليل من الأدلة التجريبية المباشرة عليها (انظر الروابط في نهاية الخبر).
أضاف علماء الأحياء الأمريكيون الذين يعملون مع عاثية لامدا (انظر عاثية لامدا) عرضًا آخر إلى مجموعة الأمثلة المؤكدة لفعالية هذه الآلية.
تمت دراسة الابتكار التطوري الذي ينشأ بشكل منهجي في العاثيات في ظل ظروف معينة. عادة، تصيب هذه العاثيات ضحاياها، الإشريكية القولونية الإشريكية القولونية، ملتصقًا بالبروتين السطحي (المستقبل) LaMB. ومع ذلك، يمكن للضحايا تطوير مقاومة للفيروس من خلال تراكم الطفرات التي تقلل من مستوى التعبير عن هذا المستقبل. يتناقص عدد جزيئات LamB الموجودة على سطح الخلايا البكتيرية، ولا يكون لدى الفيروس ما يمكن الإمساك به.
في ظل وجود البكتيريا المقاومة، تخضع الفيروسات لانتقاء مكثف لقدرتها على التشبث بأكبر قدر ممكن من الكفاءة لجزيئات LaB القليلة المتبقية. يعمل الانتقاء على إصلاح 4-7 طفرات على التوالي في الجين الفيروسي الذي يشفر بروتين J. يقع هذا البروتين في نهاية جذع الفيروس وهو مسؤول عن الارتباط بـ LamB (الشكل 1).
وبشكل غير متوقع، لا تؤدي هذه الطفرات إلى زيادة قوة الارتباط بـ LamB فحسب، بل تمنح بروتين J أيضًا قدرة جديدة - على الارتباط ببروتين سطحي آخر من البكتيريا، وهو OmpF. في الواقع، يطوّر الفيروس طريقة جديدة لإصابة الخلايا البكتيرية. تنجح مثل هذه الفيروسات في إصابة البكتيريا التي تفتقر تمامًا إلى LamB (J. R. Meyer et al., 2012. التكرار والطوارئ في تطور الابتكار الرئيسي في Phage Lambda).
لقد تبين مؤخرًا أن الفيروسات العامة الناتجة (القادرة على إصابة ضحاياها بطريقتين) يمكنها بعد ذلك التخصص مرة أخرى، أي تفقد إحدى طريقتي العدوى، مما يؤدي إلى تحسين الآخر. وهذا يمكن أن يؤدي إلى نوع من أنواع (الانقسام إلى نوعين). على الرغم من أن العاثيات لا تتكاثر جنسيًا، إلا أنها تحتوي على إعادة التركيب - تبادل أجزاء الجينوم بين الفيروسات التي تصيب نفس الخلية. ومن حيث العواقب التطورية، فإن هذا يماثل تقريبًا التكاثر الجنسي. وتبين أن التكيف مع المضيفين الذين لديهم واحد فقط من المستقبلين (LamB أو OmpF) يؤدي إلى تقسيم الفيروسات العامة إلى مجموعتين متخصصتين، كل منهما قادرة على إصابة نوع واحد فقط من الضحايا. لم تعد هذه الفيروسات قادرة على تبادل الجينات مع بعضها البعض، لأن الطفرات غير المتوافقة ثابتة في جينوماتها (J. R. Meyer et al., 2016. الانتواع البيئي للبكتيريا لامدا في التباين والتعاطف). ولذلك، يمكن اعتبارها أنواعا مختلفة.
وفي دراسة جديدة نشرت نتائجها في المجلة علوماكتشف علماء الفيروسات الأمريكيون كيف يتمكن البروتين J الموجود في الفيروسات العامة من الجمع بين وظيفتين. في الكائنات الخلوية، تحدث مثل هذه التغيرات التطورية عادةً من خلال ازدواج الجينات مع تقسيم الوظائف لاحقًا بين النسخ. لكن العاثيات العامة لديها جين جغير مكررة.
آلية بديلة تنطوي على زعزعة استقرار البروتين. اقترح المؤلفون أن الطفرات ثابتة في الجين جفي العاثيات العامة، أدخلت عنصرًا من الفوضى في عملية طي البروتين المشفر (انظر طي البروتين). من الممكن أن يتبنى بروتين J الموجود في العاثيات العامة شكلين مختلفين، أحدهما يرتبط بـ LamB والآخر بـ OmpF.
غالبًا ما يكون زعزعة استقرار البنية المكانية للبروتين مصحوبًا بانخفاض في مقاومته لدرجات الحرارة المرتفعة. ولذلك، بدأ العلماء في اختبار فرضيتهم من خلال تقييم قدرة الفيروسات على تحمل الحرارة الزائدة. وللقيام بذلك، احتفظوا بالجزيئات الفيروسية ذات الأنماط الجينية المختلفة في درجات حرارة مختلفة لمدة ساعة (من 37 درجة مئوية - درجة الحرارة المثالية للعاثية 5 إلى 55 درجة مئوية مميتة) ونظروا في النسبة المئوية للفيروسات التي ظلت قابلة للحياة. استخدمت التجربة أنماطًا وراثية تتوافق مع مراحل مختلفة من المسار التطوري الذي تمت دراسته مسبقًا من الفيروس الأصلي (المرتبط فقط بـ LamB) إلى الفيروس العام. اختلفت الفيروسات التي تمت دراستها فقط في الطفرات الجينية ج، وكان بقية الجينوم الخاص بهم هو نفسه.
وأكدت النتائج توقعات الباحثين (الشكل 2). واتضح أن الطفرات في الجين ج، والتي، أثناء تكيف الفيروسات مع الضحايا الذين يعانون من انخفاض التعبير عن LamB، زادت من تقارب J لـ LamB، ثم جعلت من الممكن الارتباط أيضًا بـ OmpF، مما أدى في نفس الوقت إلى تقليل الثبات الحراري لبروتين J.

ومع ذلك، فإن هذا في حد ذاته لا يعني شيئًا، لأن الطفرات التي تغير تسلسل الأحماض الأمينية للبروتينات غالبًا ما تقلل من مقاومة البروتين لارتفاع درجة الحرارة - وهذا أمر شائع. ولكن في هذه الحالة، تبين أن كل شيء أكثر إثارة للاهتمام. اختبر المؤلفون الحساسية الحرارية للفيروسات المذكورة أعلاه - أحفاد العموميين، الذين أصبحوا مرة أخرى متخصصين خلال مزيد من التطور، بعد أن فقدوا القدرة على الارتباط بأحد المستقبلين. تحتوي هذه الفيروسات على "متخصصين ثانويين" في الجين جطفرات أكثر مقارنة بالنسخة الأصلية من العموميين. ومع ذلك، تبين أن مقاومتها للحرارة عالية مثل مقاومة الفيروسات "البرية". ومن ثم، فإن الطفرات "المعممة" تقلل من الثبات الحراري، في حين أن الطفرات "المتخصصة" تزيده مرة أخرى.
تم الحصول على النتيجة الأكثر إثارة للاهتمام عندما قام الباحثون بتحليل الوقت فيوديناميكيات تدمير الجزيئات الفيروسية عند درجة حرارتها المثلى البالغة 37 درجة مئوية. استخدمت التجربة سلالات ذات مقاومة للحرارة القصوى والدنيا، أي "النوع البري" والفيروسات العامة ذات سبع طفرات (الخطوط الصلبة السوداء والخضراء في الشكل 2 تتوافق مع هذين النمطين الوراثيين). اتضح أن العموميين يتم تدميرهم بمرور الوقت بشكل أسرع من الفيروسات "البرية". وهذه نتيجة متوقعة، لأنه من المتوقع أن تكون الفيروسات الأقل مقاومة للحرارة أقل استقرارًا عند درجة الحرارة المثلى. شيء آخر أكثر إثارة للاهتمام: وجد الباحثون أنه خلال اليومين الأولين، يحدث تدمير الفيروسات من النوع البري بمعدل ثابت، بينما تتحلل الفيروسات العامة بشكل أسرع بكثير في اليوم الأول منها في اليوم الثاني (الشكل 3).

ولكن إذا كانت جميع الجزيئات الفيروسية في العينة متماثلة، فيجب تدميرها بمعدل ثابت. تشير النتيجة التي تم الحصول عليها إلى أن الفيروسات العامة تبدو ممثلة بنمطين ظاهريين مختلفين، أحدهما غير مستقر ويتم تدميره بسرعة (بشكل رئيسي خلال اليوم الأول)، والآخر ببطء (بنفس سرعة الفيروسات "البرية" تقريبًا). ومع ذلك، فإن جميع العموميين لديهم نفس النمط الجيني. لذلك، نحن نتحدث عن التباين غير الجيني. على الأرجح، يرجع ذلك إلى المتغيرات القابلة للطي المختلفة للبروتين J.
قدمت تجارب أخرى عددًا من التأكيدات غير المباشرة لهذا الافتراض. كان من الممكن إظهار أن الجزء سريع التحلل من الفيروسات العامة يرتبط بشكل تفضيلي بـ OmpF، والجزء الذي يتحلل ببطء يرتبط بـ LamB. يتضح هذا، على سبيل المثال، من حقيقة أنه مع تدمير الجزيئات الفيروسية، يبقى عدد أقل وأقل من الفيروسات العامة قادرة على الارتباط بـ OmpF، في حين تزداد نسبة تلك الارتباطات بـ LamB. وإذا قمت بتحديد تلك الفيروسات المرتبطة بـ OmpF، فإن الفيروسات المتبقية، أولاً، ترتبط بـ LamB بشكل أفضل من الخليط الأصلي، وثانيًا، يتم تدميرها بشكل أبطأ بمرور الوقت. وأكدت تجارب إضافية أن التباين في الفيروسات العامة هو في الواقع غير وراثي، أي غير وراثي.
ونتيجة لذلك، ظهر المخطط التالي لظهور الابتكار التطوري. أثناء التكيف مع الضحايا الذين يعانون من انخفاض التعبير عن مستقبل LamB، بدأ الانتقاء في دعم مثل هذه الطفرات في جين الفيروس ج، مما سمح لبروتين J بالارتباط بشكل أكثر إحكامًا بـ LamB. تم تحقيق ذلك على حساب زعزعة استقرار البروتين J، والذي، نتيجة لذلك، بدأ أحيانًا في الطي بشكل غير صحيح. بعد الحصول على أربع طفرات من هذا القبيل (كل منها أدت إلى زيادة ألفة J لـ LamB)، اكتسب البروتين J متغيرًا جديدًا قابلاً للطي سمح له بالارتباط بمستقبل آخر، OmpF. نشأ بروتين ذو وظيفة جديدة كأحد متغيرات النمط الظاهري في إطار التباين غير الوراثي. وبالنظر إلى نفس الجينوم، يمكن لبعض الفيروسات الآن الارتباط بـ OmpF، في حين أن البعض الآخر من نفس النمط الجيني يرتبط بـ LamB. هكذا ظهرت الفيروسات العامة. علاوة على ذلك، فإن كل جسيم فيروسي فردي يرتبط بكفاءة أكبر بأحد المستقبلين مقارنة بالآخر. التعميم حدث على مستوى السكان وليس على المستوى الفردي.
في المستقبل، يمكن للفيروسات العامة أن تتخصص مرة أخرى عندما تجد الظروف المناسبة (أي، الوصول إلى الضحايا الذين لديهم LamB فقط أو OmpF فقط). أثناء التخصص، يتم إصلاح الطفرات التي تزيد من احتمال طي البروتين J بطريقة مفيدة في موقف معين. ونتيجة لذلك، يستقر البروتين J مرة أخرى، أي أنه يبدأ في الطي بطريقة واحدة فقط. وفي الوقت نفسه، يتم أيضًا استعادة مقاومة البروتين (والفيروس بأكمله) لدرجات الحرارة المرتفعة.
وهكذا تم العثور على مثال صارخ لظهور وظيفة جديدة من خلال مرحلة وسيطة مرتبطة بزعزعة استقرار النمط الظاهري. ويظل من غير الواضح عدد المرات التي تنشأ فيها الابتكارات التطورية بهذه الطريقة في الفيروسات والكائنات الخلوية. مزيد من البحث يجب أن يجيب على هذا السؤال.
إن عمل البروتينات ووظائفها يكمن وراء بنية أي كائن حي وجميع التفاعلات الحياتية التي تحدث فيه. أي تعطيل لهذه البروتينات يؤدي إلى تغييرات في رفاهيتنا وصحتنا. تكمن الحاجة إلى دراسة بنية البروتينات وخصائصها وأنواعها في تنوع وظائفها.
الكلمات الأولى من تعريف ف. إنجلز لمفهوم الحياة "الحياة هي طريقة وجود الأجسام البروتينية، ..." لا تزال، بعد قرن ونصف، لم تفقد صحتها وأهميتها.
الوظيفة الهيكلية
مادة النسيج الضام والمصفوفة بين الخلايا تشكل البروتينات الكولاجين , الإيلاستين, الكيراتين, البروتيوغليكان .
يشارك بشكل مباشر في بناء الأغشية والهيكل الخلوي (البروتينات المتكاملة وشبه المتكاملة والسطحية) – سبكترين(السطح، البروتين الرئيسي للهيكل الخلوي للكريات الحمراء)، الجليكوفورين(متكامل، يعمل على تثبيت السبيكترين على السطح).
تتضمن هذه الوظيفة المشاركة في تكوين العضيات - الريبوسومات.
الوظيفة الأنزيمية
الجميع الانزيماتهي البروتينات.
وفي نفس الوقت هناك دليل على وجوده الريبوزيمات، أي. الأحماض النووية الريبية ذات النشاط التحفيزي.
الوظيفة الهرمونية
تعمل الهرمونات على تنظيم وتنسيق عملية التمثيل الغذائي في خلايا الجسم المختلفة. الهرمونات مثل الأنسولينو الجلوكاجونهي بروتينات، وجميع هرمونات الغدة النخامية عبارة عن ببتيدات أو بروتينات صغيرة.
وظيفة الاستقبال
تتكون هذه الوظيفة من الارتباط الانتقائي للهرمونات والمواد النشطة بيولوجيًا والوسطاء على سطح الأغشية أو داخل الخلايا.
وظيفة النقل
البروتينات فقط هي التي تنقل المواد في الدم، على سبيل المثال، البروتينات الدهنية(نقل الدهون) الهيموجلوبين(ربط الأكسجين)، هابتوغلوبين (نقل الهيم)، ترانسفيرين(نقل الحديد). تنقل البروتينات الكالسيوم والمغنيسيوم والحديد والنحاس والأيونات الأخرى في الدم.
نقل المواد من خلال الأغشيةتنفيذ البروتينات - نا +، ك + -ATPase(نقل الغشاء المضاد للاتجاه لأيونات الصوديوم والبوتاسيوم) ، كا 2+ -ATPase(ضخ أيونات الكالسيوم إلى خارج الخلية)، ناقلات الجلوكوز.
وظيفة الاحتياطي
مثال على البروتين المخزن هو إنتاج وتراكم في البيضة زلال البيض.
ليس لدى الحيوانات والبشر مثل هذه المستودعات المتخصصة، ولكن أثناء الصيام الطويل، يتم استخدام البروتينات العضلات والأعضاء اللمفاوية والأنسجة الظهاريةو الكبد.
وظيفة مقلصة
هناك عدد من البروتينات داخل الخلايا المصممة لتغيير شكل الخلية وحركة الخلية نفسها أو عضياتها ( توبولين, أكتين, الميوسين).
وظيفة الحماية
يتم تنفيذ وظيفة الحماية، ومنع العملية المعدية والحفاظ على استقرار الجسم المناعيةالدم، عوامل النظام إطراء(properdin)، في حالة تلف الأنسجة فإنها تعمل بروتينات التخثرالدم - على سبيل المثال، الفيبرينوجين، البروثرومبين، الجلوبيولين المضاد للهيموفيليا. ميكانيكييتم توفير الحماية على شكل الأغشية المخاطية والجلد بواسطة الكولاجين و البروتيوغليكان .
تتضمن هذه الوظيفة أيضًا الحفاظ على الاتساق الاسموزي الغروانيضغط الدم، والنسيج الخلالي والمساحات داخل الخلايا، بالإضافة إلى الوظائف الأخرى لبروتينات الدم.
ويشارك نظام المخزن المؤقت للبروتين في الحفاظ على الحالة الحمضية القاعدية .
هناك بروتينات تخضع لدراسة خاصة:
مونيلين– معزول من نبات أفريقي، ذو طعم حلو جداً، غير سام ولا يساهم في السمنة.
ريسيلين- تتمتع بمرونة مثالية تقريبًا، وتشكل "مفصلات" عند نقاط التعلق بأجنحة الحشرات.
البروتينات ذات الخصائص مضاد للتجمدالموجودة في أسماك القطب الجنوبي، فهي تحمي الدم من التجمد
- إلى الأمام >
إن تعقيد بنية جزيئات البروتين والتنوع الشديد في وظائفها يجعل من الصعب للغاية إنشاء تصنيف واضح واحد لها على أي أساس. يمكن تصنيف البروتينات وفقًا لتركيبتها (بسيطة ومعقدة)، وبنيتها (ليفية، كروية، متوسطة)، ووظائفها. دعونا نلقي نظرة فاحصة على التصنيف الهيكلي.
ليفيالبروتينات ممدودة للغاية (البنية الثانوية هي الأكثر أهمية) وتؤدي وظائف هيكلية.
كرويالبروتينات ، والتي يمكن تمثيلها تقريبًا في شكل مجالات (أهمها البنية الثلاثية) ، تشارك في عمليات محددة مثل التحفيز والنقل والتنظيم.
بالإضافة إلى أنواع البروتينات المذكورة أعلاه، يحتوي الجسم على ببتيدات صغيرة أو منخفضة الكربون، والتي قد لا يكون لها بنية ثابتة، ولكنها تكتسبها عند التفاعل مع الجزيئات الكبيرة الأخرى. تجدر الإشارة إلى أن هذا التصنيف لا يمكن أن يدعي اكتماله، حيث أن هناك بروتينات لا تنتمي إلى أي من هذه الفئات. على سبيل المثال، الميوسين، الذي يحتوي في بنيته على خصائص كل من البروتينات الليفية والبروتينات الكروية.
يسمى البروتين الذي له ترتيب السلسلة الطبيعية الأصلي، أي أن له تكوين ثلاثي الأبعاد محلي،بروتين ذو سلسلة مطوية بشكل عشوائي - مشوهةيسمى تحول البروتين الأصلي إلى بروتين مشوه، أي أن البروتين يفقد تكوينه ثلاثي الأبعاد، تمسخ(الشكل 3.15). مجموعة متنوعة من العوامل يمكن أن تسبب تمسخ. على وجه الخصوص، عادة ما يتم تعطيل التعبئة الضيقة لسلسلة البروتين عن طريق التسخين. تمسخ الطبيعة الحراري هو خاصية عامة للبروتينات. بعد تمسخ الطبيعة، يمكن للبروتين النشط بيولوجيًا أن يطوى تلقائيًا إلى شكله الأصلي ويستعيد نشاطه. تسمى عملية طي البروتين المشوه إعادة الطبيعة.

أرز. 3.15. تمسخ جزيء البروتين:
أ- الحالة الأولية؛ ب - بداية اضطراب عكسي للبنية الجزيئية؛ الخامس- تتكشف لا رجعة فيه لسلسلة البولي ببتيد
مع التعرض لفترة طويلة لعامل تغيير طبيعة (درجة الحرارة، مادة كيميائية، بيئة ذات درجة حموضة مختلفة)، يصبح تمسخ الطبيعة لا رجعة فيه (في الشكل 3.15، تتم الإشارة إلى هذه العملية بواسطة سهم بين حالات جزيء البروتين بو الخامس).تفسد معظم البروتينات عندما يتم تسخين محاليلها فوق 50-60 درجة مئوية.
يفقد البروتين المشوه قدرته على الذوبان في الماء. العلامة الأكثر تميزًا للتمسخ هي الانخفاض الحاد أو الفقدان الكامل للنشاط البيولوجي للبروتين (التحفيزي أو المستضدي أو الهرموني). حقيقة أن البروتين المشوه يفقد خصائصه البيولوجية بالكامل تؤكد العلاقة الوثيقة بين بنية جزيء البروتين والوظيفة التي يؤديها في الجسم.
تشير قدرة جزيء البروتين على إعادة التشكل تلقائيًا عند إزالة التأثير العدواني الخارجي إلى أن تسلسل الأحماض الأمينية نفسه يحدد البنية المكانية للبروتين دون مشاركة أي مركز تنظيمي خارجي.
حاليا، تمسخ وإعادة طبيعة البروتينات الكروية في المختبرتتم دراستها بشكل مكثف، لأن هذه العمليات مرتبطة بمشكلة التنظيم الذاتي للبروتين، أي مع مسألة كيف "تجد" سلسلة البروتين بنيتها الفريدة بين عدد هائل من البدائل الممكنة.
البروتينات الليفيةتشكل أساس المواد غير القابلة للذوبان في الماء والمتينة، مثل القرون والحوافر والأظافر والصوف والشعر والريش والجلد والأوتار والمواد بين الخلايا من أنسجة العظام. الشعر عبارة عن ألياف طويلة وقوية إلى حد ما، وأساسها البروتين - الكيراتين.يوجد في قلب الأوتار بروتين آخر - الكولاجين.يعطي مرونة ومرونة لجدران الشرايين أو الحويصلات الرئوية الإيلاستين.السمة المشتركة لهذه البروتينات هي المشاركة في تكوين بنيتها المكانية للروابط التساهمية غير الببتيدية.
الكيراتينشكل الشعر والصوف المتوسطة الشعيرات،تتكون من سلاسل بولي ببتيد طويلة ذات مجالات كبيرة مكونة من حلزونات ألفا وتحتوي على تسلسلات متكررة من سبعة بقايا من الأحماض الأمينية (سباعي الببتيدات). تشكل سلسلتان من الكيراتين موجهتان بشكل متماثل حلزونًا فائقًا، حيث تكون بقايا الأحماض الأمينية غير القطبية متجهة إلى الداخل وبالتالي تكون محمية من تأثيرات الماء. يتم تثبيت هذا الهيكل بشكل أكبر من خلال روابط ثاني كبريتيد عديدة مكونة من بقايا السيستين من السلاسل المجاورة. تتحد الثنائيات الفائقة الحلزونية بدورها لتشكل رباعيات، تشبه الحبل ذي الأربعة خيوط.
الكولاجينتتكون خلايا خارجية من البروتين الذي تفرزه - بروكولاجين,والذي يتحول إلى كولاجين نتيجة تفاعل الإنزيمات المناسبة. جزيء البروكولاجين عبارة عن حلزون ثلاثي فائق يتكون من ثلاثة ببتيدات متخصصة ملتوية معًا. وعلاوة على ذلك، عند انقسام الببتيدات الطرفية، تروبوكولاجين,والتي يتم تعبئتها في ألياف الكولاجين. كل واحد من الببتيدات الثلاثة الموجودة في التروبوكولاجين يكون على شكل حلزون أعسر (على عكس حلزونات ألفا المعتادة الموجودة في البروتينات). يتم تمثيل حوالي ثلث بقايا الأحماض الأمينية في التروبوكولاجين بالبرولين، وكل بقايا ثالثة عبارة عن الجلايسين.
أثناء تكوين الكولاجين، يتم هيدروكسيل العديد من بقايا البرولين والليسين في وجود حمض الأسكوربيك، وتتحول إلى هيدروكسي برولين وهيدروكسي ليسين، على التوالي:

يتم تضمين هذه البقايا في البروتين ليس أثناء تخليق المصفوفة، ولكن نتيجة للمواد الكيميائية التحول ما بعد الترجمةالأحماض الأمينية التي يحتوي عليها. يتطلب هيدروكسيل البرولين حمض الأسكوربيك (فيتامين C) كعامل مساعد (مكون غير بروتيني ضروري للتشغيل الفعال)، وهو ضروري للحفاظ على الحالة المنخفضة لأيون Fe 2+ في المركز النشط لإنزيم بروليل هيدروكسيلاز. مع نقص فيتامين C، يتم انتهاك تكوين الأنسجة الضامة، مما يسبب مرض خطير - الاسقربوط.
ترتبط ثلاث جزيئات التروبوكولاجين ذات الجرح الحلزوني ببعضها البعض بشكل تساهمي، مما يشكل بنية قوية. مثل هذا الارتباط غير ممكن في حلزون البروتين التقليدي، لأن السلاسل الجانبية الضخمة تمنعه. في الكولاجين، تكون الحلزونات أكثر استطالة (هناك 3 بقايا في كل دورة، بدلاً من 3.6)، نظرًا لأن كل بقايا حمض أميني ثالث عبارة عن جليكاين، وبالتالي فإن الحلزونات عند هذه النقاط تكون قريبة من بعضها البعض قدر الإمكان. يتم إجراء التثبيت الإضافي للهيكل بواسطة روابط هيدروجينية من بقايا الليسين الهيدروكسيل والبرولين.
تحتوي جزيئات التروبوكولاجين على حوالي 1000 بقايا من الأحماض الأمينية. تتجمع في ألياف الكولاجين، وتتصل من الرأس إلى الذيل. يمكن أن تكون الفراغات الموجودة في هذا الهيكل، إذا لزم الأمر، بمثابة موقع للترسيب الأولي لبلورات هيدروكسيباتيت Ca 5 (0H)(P0 4)3، والتي تلعب دورًا مهمًا في تمعدن العظام.
يخضع كولاجين الوتر لتعديل إنزيمي - حيث ترتبط بقايا الليسين بشكل تساهمي في الأجزاء الطرفية من سلاسل التروبوكولاجين. وبالتالي، فإن الأوتار عبارة عن حزم من ألياف ليفية متوازية الاتجاه. على عكس الأوتار الموجودة في الجلد، تشكل ألياف الكولاجين نوعًا من الشبكة غير المنتظمة ثنائية الأبعاد.
الإيلاستينتركيبته تختلف عن الكولاجين والكيراتين. يحتوي على حلزونات ألفا عادية تشكل شبكة مترابطة، والتي تدين بمرونتها العالية بشكل غير عادي إلى الطريقة الفريدة التي ترتبط بها السلاسل الجانبية لليسين:
أربعة بقايا يسين متباعدة بشكل وثيق 
تشكيل ما يسمى ديسموزينهيكل يجمع أربعة أقسام من سلاسل الببتيد في وحدة واحدة (الشكل 3.16).

أرز. 3.16. التركيب الكيميائي للديسموزين
البروتينات الكروية. معظم جزيئات البروتين في الجسم لها بنية كروية. يتم طي الرابطة الببتيدية في البروتينات الكروية في حالتها الطبيعية إلى هياكل مدمجة - الكريات,والتي، للتقريب التقريبي الأول، يمكن تمثيلها على شكل كرة أو شكل إهليلجي غير ممدود للغاية، على عكس البروتينات الليفية، حيث تكون سلاسل البوليببتيد الطويلة ممدودة على طول محور واحد.
تكون الكريات مستقرة في الأنظمة المائية نظرًا لحقيقة أن المجموعات القطبية من السلاسل الرئيسية والجانبية تتركز على السطح، وتكون على اتصال بالماء، بينما تواجه المجموعات غير القطبية عمق الجزيء وتكون محمية من هذا التلامس. تتشكل الروابط الأيونية أحيانًا على سطح كرية البروتين - الجسور الملحية.
مجموعات >N-H و >C=0 من السلسلة الرئيسية الموجودة داخل الكرية مع روابط هيدروجينية مشكلة تشكل حلزونات a و(3 طبقات).عامل زعزعة استقرار التعبئة المكانية هو وجود بعض المجموعات في أعماق الكرية التي من المحتمل أن تكون قادرة على تكوين اتصالات أيونية وهيدروجينية، ولكنها في الواقع محرومة من الشركاء.
في ظل الظروف الفسيولوجية، تكون حالة البروتين ذو البنية الأصلية ثلاثية الأبعاد مستقرة من الناحية الديناميكية الحرارية، أي أنها تتوافق مع الحد الأدنى من الطاقة الحرة. المعلومات اللازمة لطي البروتين إلى شكله الأصلي موجودة في تسلسل الأحماض الأمينية. لذلك، من حيث المبدأ، من الممكن نظريًا التنبؤ بالبنية ثلاثية الأبعاد لأي بروتين بناءً على تسلسل الأحماض الأمينية الخاصة به. ومع ذلك، يظل التنبؤ بالبنية الثلاثية مشكلة لم يتم حلها في البيولوجيا الجزيئية. يجب أن يتم طي جزيء البروتين من الحالة غير المطوية بطريقة واحدة. إذا افترضنا أن جزيء البروتين يتكون من 50 وحدة بنائية، كل منها يمكن أن يأخذ 10 مطابقات مختلفة، فإن العدد الإجمالي للمطابقات المحتملة سيكون 10 50، وإذا كان الوقت المميز لإعادة الترتيب الجزيئي هو 10 «13 ثانية»، إذن بالترتيب لتجربة جميع المطابقات، سيستغرق الأمر 10 37 ثانية (~ 10 30 عامًا). ولذلك، هناك مسار موجه لطي البروتين.
استقرار جزيء البروتين المطوي في بيئة مائية منخفض للغاية. القوة الدافعة الرئيسية للطي هي التأثير الانتروبي الكاره للماء، والذي بسببه تميل المجموعات غير القطبية إلى مغادرة البيئة المائية وينتهي بها الأمر داخل الكرة. هناك أيضًا تأثير معاكس، يمنع الطي ويرجع ذلك إلى حقيقة أنه بالنسبة لجزيء البروتين المطوي، يكون عدد التطابقات المسموح بها للسلاسل الرئيسية والجانبية أقل من السلاسل غير المطوية.
الهيموجلوبين (خضاب الدم)- البروتين الذي يحمل الأكسجين من الرئتين إلى الأنسجة. يتم توطين Hb في خلايا الدم الحمراء - كريات الدم الحمراء.
كما ذكرنا سابقًا (انظر الشكل 3.14)، يتكون الهيموجلوبين من أربع سلاسل متعددة الببتيد، تحتوي كل منها على الهيم (الشكل 3.17). العلاقة الوظيفية بين هذه السلاسل هي أن إضافة O2 إلى إحدى ذرات الحديد يزيد من ألفة الأكسجين للثلاث الأخرى.
الهيموجلوبين عبارة عن فئة كاملة من البروتينات التي يختلف ممثلوها في واحد أو اثنين من بقايا الأحماض الأمينية أو تسلسلها. الشخص البالغ لديه الهيموجلوبين من نوع HLA. بالإضافة إلى HbA، هناك الهيموجلوبين الجنيني HbF، والذي يختفي بعد الولادة. الوزن الجزيئي لكلا الهيموجلوبين هو نفسه تقريبًا (64.500)، ويختلفان فقط في تسلسل بقايا الأحماض الأمينية. إلى جانب الهيموجلوبين الموجود عادةً، يوجد في جسم الإنسان غير طبيعي من HbS وHbG وHbS وHbH وما إلى ذلك، والقاسم المشترك بين جميع الهيموجلوبين هو الطريقة التي يتم بها ترتيب سلاسل البوليببتيد الخاصة بها حول حلقة مسطحة كبيرة. الهيممتماثل للجميع وفي وسطه ذرة الحديد (حلقة البورفيرين).
يتكون الهيم من ذرات الكربون والنيتروجين والهيدروجين، مما يشكل حلقة مسطحة تسمى البورفيرين (الشكل 3.17). يوجد في وسط الحلقة ذرة Fe متصلة بذرات الحلقة بواسطة أربع روابط تنسيقية (من أصل ستة روابط ممكنة). الهيم محاط ببقايا الهيستدين (His). يتم تنسيق مجموعة إيميدازول من الهيستيدين (F-8) مع ذرة الحديد من خلال رابطة التنسيق الخامسة. تعمل الرابطة السادسة على الاتصال بجزيء O2.

أرز. 3.17.
الميوجلوبين- بروتين عضلي ينقل الأكسجين في الخلايا العضلية. وهو يتألف من سلسلة بولي ببتيد واحدة، ويحتوي فقط على حلزونات ألفا متصلة بواسطة حلقات، وله هيم واحد. يختلف تسلسل الأحماض الأمينية للميوجلوبين عن تسلسل سلاسل الهيموجلوبين. ومع ذلك، فإن البنية الثلاثية لسلاسل الهيموجلوبين والميوجلوبين متطابقة. تسمى الطريقة العامة لطي حلزونات ألفا للبروتينات الكروية نوع جلوبين للطي.