سلوك الإنتروبيا في عمليات التغيير في حالة التجميع. الانتقالات بين حالات التجميع يسمى الانتقال من حالة إلى أخرى
عادة ما تسمى حالة تجميع المادة بقدرتها على الحفاظ على شكلها وحجمها. ميزة إضافية هي طرق انتقال المادة من حالة تجميع إلى أخرى. وعلى هذا يتم التمييز بين ثلاث حالات للتجمع: الصلبة والسائلة والغازية. خصائصها المرئية هي:
يحتفظ الجسم الصلب بالشكل والحجم. يمكن أن يمر إما إلى سائل عن طريق الذوبان أو مباشرة إلى الغاز عن طريق التسامي.
- السائل - يحتفظ بالحجم، ولكن ليس بالشكل، أي أنه يتمتع بالسيولة. يميل السائل المسكوب إلى الانتشار إلى أجل غير مسمى على السطح الذي يُسكب عليه. يمكن أن يصبح السائل صلبًا عن طريق التبلور، وغازًا عن طريق التبخر.
- الغاز - لا يحتفظ بالشكل أو الحجم. يميل الغاز الموجود خارج أي حاوية إلى التوسع بشكل غير محدود في جميع الاتجاهات. وحدها الجاذبية يمكن أن تمنعه من القيام بذلك، وبالتالي لا يتبدد الغلاف الجوي للأرض في الفضاء. يمر الغاز إلى السائل عن طريق التكثيف، وإلى الحالة الصلبة مباشرة عن طريق الترسيب.
التحولات المرحلة
يُسمى انتقال المادة من حالة تجميع إلى أخرى بمرحلة انتقالية، نظرًا لأن حالة التجميع العلمية هي مرحلة المادة. على سبيل المثال، يمكن أن يوجد الماء في الطور الصلب (الجليد)، والسائل (الماء العادي)، والطور الغازي (بخار الماء).
كما تم توضيح مثال الماء بشكل جيد. تم تعليقه في الفناء ليجف في يوم بارد وعاصف من الرياح، ويتجمد على الفور، ولكن بعد مرور بعض الوقت يصبح جافًا: يتسامى الجليد، ويتحول مباشرة إلى بخار الماء.
كقاعدة عامة، يتطلب انتقال المرحلة من الحالة الصلبة إلى السائل والغاز التسخين، ولكن درجة حرارة الوسط لا تزيد: يتم إنفاق الطاقة الحرارية على كسر الروابط الداخلية في المادة. وهذا ما يسمى بالحرارة الكامنة. أثناء التحولات الطورية العكسية (التكثيف، التبلور)، يتم إطلاق هذه الحرارة.
هذا هو السبب في أن الحروق بالبخار خطيرة للغاية. عندما يصل إلى الجلد، فإنه يتكثف. الحرارة الكامنة لتبخر/تكثيف الماء عالية جدًا: الماء في هذا الصدد مادة شاذة؛ ولهذا السبب فإن الحياة على الأرض ممكنة. في حالة حرق البخار، فإن الحرارة الكامنة لتكثيف الماء "تحرق" المنطقة المحروقة بعمق شديد، وتكون عواقب حرق البخار أشد بكثير من عواقب اللهب على نفس المنطقة من الجسم.
المراحل الزائفة
يتم تحديد سيولة الطور السائل للمادة من خلال لزوجتها، ويتم تحديد اللزوجة من خلال طبيعة الروابط الداخلية، والتي سيتم مناقشتها في القسم التالي. يمكن أن تكون لزوجة السائل عالية جدًا، ويمكن أن يتدفق هذا السائل دون أن تلاحظه العين.
والمثال الكلاسيكي هو الزجاج. إنه ليس مادة صلبة، ولكنه سائل لزج للغاية. يرجى ملاحظة أن الألواح الزجاجية في المستودعات لا يتم تخزينها أبدًا بشكل مائل على الحائط. وفي غضون أيام قليلة سوف تنحني تحت ثقلها ولن تكون صالحة للاستهلاك.
ومن الأمثلة الأخرى على المواد الصلبة الزائفة تلميع الأحذية وقار البناء. إذا نسيت قطعة من البيتومين على السطح، فسوف تنتشر خلال الصيف على شكل كعكة وتلتصق بالقاعدة. يمكن تمييز الأجسام الصلبة الزائفة عن الأجسام الحقيقية من خلال طبيعة الذوبان: فالأجسام الحقيقية إما تحتفظ بشكلها حتى تنتشر على الفور (لحام أثناء اللحام)، أو تطفو، وتطلق البرك والجداول (الجليد). وتلين السوائل شديدة اللزوجة تدريجيًا، مثل القار أو البيتومين.
البلاستيك عبارة عن سوائل شديدة اللزوجة، ولا يمكن ملاحظة سيولتها لسنوات وعقود عديدة. يتم ضمان قدرتها العالية على الاحتفاظ بالشكل من خلال الوزن الجزيئي الضخم للبوليمرات وعدة آلاف وملايين ذرات الهيدروجين.
هيكل المرحلة من المادة
في الطور الغازي، تكون جزيئات أو ذرات المادة متباعدة جدًا عن بعضها البعض، أكبر بعدة مرات من المسافة بينها. وهي تتفاعل مع بعضها البعض في بعض الأحيان وبشكل غير منتظم، فقط أثناء الاصطدامات. التفاعل نفسه مرن: لقد اصطدموا مثل الكرات الصلبة وتناثروا على الفور.
في السائل، "تشعر" الجزيئات/الذرات ببعضها البعض باستمرار بسبب الروابط الضعيفة جدًا ذات الطبيعة الكيميائية. تنكسر هذه الروابط طوال الوقت ويتم استعادتها على الفور مرة أخرى، حيث تتحرك جزيئات السائل باستمرار بالنسبة لبعضها البعض، وهذا هو سبب تدفق السائل. ولكن لتحويله إلى غاز، تحتاج إلى كسر جميع الروابط مرة واحدة، وهذا يتطلب الكثير من الطاقة، ولهذا السبب يحتفظ السائل بحجمه.
وفي هذا الصدد، يختلف الماء عن المواد الأخرى في أن جزيئاته الموجودة في السائل ترتبط بما يسمى بالروابط الهيدروجينية، وهي قوية جدًا. لذلك، يمكن أن يكون الماء سائلاً عند درجة حرارة طبيعية للحياة. العديد من المواد التي يزيد وزنها الجزيئي عن وزن الماء بعشرات ومئات المرات تكون في الظروف العادية غازات مثل الغاز المنزلي العادي.
في المادة الصلبة، تكون جميع جزيئاتها ثابتة في مكانها بسبب الروابط الكيميائية القوية بينها، مما يشكل شبكة بلورية. تتطلب البلورات ذات الشكل المنتظم ظروفًا خاصة لنموها، وبالتالي فهي نادرة في الطبيعة. معظم المواد الصلبة عبارة عن تكتلات من بلورات صغيرة وصغيرة - بلورات - مقترنة بإحكام بقوى ميكانيكية وكهربائية.
إذا كان القارئ قد رأى، على سبيل المثال، عمودًا متصدعًا لسيارة أو شبكة من الحديد الزهر، فإن حبيبات البلورات الموجودة على الخردة تكون مرئية بالعين المجردة. وعلى شظايا الخزف أو الخزف المكسور يمكن رؤيتها تحت عدسة مكبرة.
بلازما
يحدد الفيزيائيون أيضًا الحالة الرابعة للمادة – البلازما. وفي البلازما يتم فصل الإلكترونات عن نوى الذرة، وهي عبارة عن خليط من الجسيمات المشحونة كهربائيا. يمكن أن تكون البلازما كثيفة جدًا. على سبيل المثال، سنتيمتر مكعب واحد من البلازما من داخل النجوم - الأقزام البيضاء - يزن عشرات ومئات الأطنان.
يتم عزل البلازما في حالة منفصلة من التجميع لأنها تتفاعل بنشاط مع المجالات الكهرومغناطيسية بسبب حقيقة أن جزيئاتها مشحونة. في الفضاء الحر، تميل البلازما إلى التوسع والتبريد والتحول إلى غاز. ولكن تحت تأثير المجالات الكهرومغناطيسية، يمكنه الاحتفاظ بشكله وحجمه خارج الوعاء، مثل الجسم الصلب. تُستخدم خاصية البلازما هذه في مفاعلات الطاقة النووية الحرارية - النماذج الأولية لمحطات توليد الطاقة في المستقبل.
تتكون أي مادة من جزيئات، وتعتمد خواصها الفيزيائية على كيفية ترتيب الجزيئات وكيفية تفاعلها مع بعضها البعض. في الحياة العادية، نلاحظ ثلاث حالات إجمالية للمادة - الصلبة والسائلة والغازية. اعتمادًا على درجة الحرارة والضغط (الظروف)، يمكن أن تكون معظم المواد في حالات غازية أو سائلة أو صلبة، تسمى الحالات الإجمالية للمادة. يتم تحديد الفرق بين حالات التجميع الثلاث من خلال المسافة بين الجزيئات ودرجة تفاعلها.
| حالة المادة | خصائص المادة | مسافة الجسيمات | تفاعل الجسيمات | طبيعة الحركة | ترتيب الترتيب |
| غاز | لا يحتفظ بالشكل أو الحجم | أكبر بكثير من حجم الجزيئات نفسها | ضعيف | فوضوي (غير منظم) مستمر. إنهم يطيرون بحرية، ويصطدمون في بعض الأحيان. | فوضوي |
| سائل | لا يحتفظ بالشكل، يحتفظ بالحجم | مقارنة بحجم الجزيئات نفسها | قوي | وهي تتأرجح حول موضع التوازن، وتقفز باستمرار من مكان إلى آخر. | فوضوي |
| صلب | يحافظ على الشكل والحجم | صغيرة مقارنة بحجم الجزيئات نفسها | قوي جدا | يتأرجح باستمرار حول موضع التوازن | بترتيب معين |
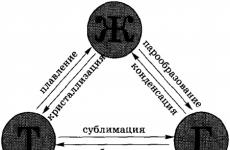
العمليات التي هناك تغير في الحالات الإجمالية للمواد، ستة في المجموع.يسمى تحول المادة من الحالة الصلبة إلى السائلة ذوبانعملية عكسية – بلورة. عندما تتحول المادة من الحالة السائلة إلى الحالة الغازية فإنها تسمى تبخيرمن الغاز إلى السائل – تركيز. تسمى عملية الانتقال من الحالة الصلبة إلى الحالة الغازية مباشرة متجاوزة الحالة السائلة تساميعملية عكسية – إزالة التسامي.
· 1. الذوبان
· 2. التبلور
· 3. التبخير
· 4. التكثيف
· 5. التسامي
· 6. إزالة التسامي
أمثلة على كل هذه التحولاتلقد رأينا أنا وأنت هذا أكثر من مرة في حياتنا. يذوب الجليد لتكوين الماء، ويتبخر الماء لتكوين البخار. وفي الاتجاه المعاكس، يتحول البخار المتكثف إلى ماء مرة أخرى، والماء المتجمد يتحول إلى ثلج. وإذا كنت تعتقد أنك لا تعرف عمليات التسامي وإزالة التسامي، فلا تتسرع في الاستنتاجات. رائحة أي جسم صلب ليست أكثر من تسامي. تهرب بعض الجزيئات من الجسم لتشكل غازًا يمكننا شمه. مثال على العملية العكسية هو الأنماط الموجودة على الزجاج في الشتاء، عندما يستقر البخار الموجود في الهواء، المتجمد، على الزجاج ويشكل أنماطًا غريبة.
رابطة الهيدروجين
ما هي الرابطة الهيدروجينية؟ ومن الأمثلة المعروفة على هذا الارتباط الماء العادي (H2O). نظرًا لأن ذرة الأكسجين (O) أكثر سالبية كهربية من ذرتي الهيدروجين (H)، فإنها تسحب إلكترونات الترابط بعيدًا عن ذرات الهيدروجين. ونتيجة لإنشاء مثل هذه الرابطة القطبية التساهمية، يتم تشكيل ثنائي القطب. تكتسب ذرة الأكسجين شحنة سالبة صغيرة، وتكتسب ذرات الهيدروجين شحنة موجبة صغيرة، والتي تنجذب إلى الإلكترونات (زوجها الوحيد) الموجودة على ذرة الأكسجين في جزيء H2O المجاور (أي الماء). وبالتالي، يمكننا القول أن الرابطة الهيدروجينية هي قوة تجاذب تتشكل بين ذرة الهيدروجين وذرة سالبة الكهربية. من السمات المهمة لذرة الهيدروجين أن جذب إلكتروناتها الرابطة يكشف جوهرها (أي البروتون، الذي لا يكون محميًا بإلكترونات أخرى). وعلى الرغم من أن الرابطة الهيدروجينية أضعف من الرابطة التساهمية، إلا أن هذا هو بالضبط ما يحدد عددًا من الخصائص الشاذة لـ H2O (الماء).
في أغلب الأحيان، يتم تشكيل هذه الرابطة بمشاركة ذرات العناصر التالية: الأكسجين (O)، النيتروجين (N) والفلور (F). ويحدث ذلك لأن ذرات هذه العناصر صغيرة الحجم وتتميز بسالبية كهربية عالية. مع الذرات الأكبر حجمًا (الكبريت S أو الكلور Cl)، تكون الرابطة الهيدروجينية المتكونة أضعف، على الرغم من حقيقة أن هذه العناصر قابلة للمقارنة في السالبية الكهربية مع N (أي النيتروجين).
هناك نوعان من الروابط الهيدروجينية:
1.الرابطة الهيدروجينية بين الجزيئات– يظهر بين جزيئين مثلا: الميثانول، الأمونيا، فلوريد الهيدروجين
2. الرابطة الهيدروجينية داخل الجزيئات– يظهر داخل جزيء واحد مثلا : 2- نيتروفينول .
ويعتقد أيضًا حاليًا أن الروابط الكيميائية الهيدروجينية يمكن أن تكون ضعيفة وقوية. وهي تختلف عن بعضها البعض في الطاقة وطول الرابطة (المسافة بين الذرات):
1. الروابط الهيدروجينية ضعيفة. الطاقة – 10-30 كيلوجول/مول، طول الرابطة – 30. جميع المواد المذكورة أعلاه هي أمثلة على الروابط الهيدروجينية العادية أو الضعيفة.
2. الروابط الهيدروجينية قوية. الطاقة – 400 كيلوجول/مول، الطول – 23-24. تشير البيانات التجريبية إلى أن الروابط القوية تتشكل في الأيونات التالية: أيون ثنائي فلوريد الهيدروجين -، أيون الهيدروكسيد المائي -، أيون الأوكسونيوم المائي +، وكذلك في مختلف المركبات العضوية وغير العضوية الأخرى.
اعتمادًا على الظروف، يمكن أن تكون الأجسام في حالة سائلة أو صلبة أو غازية. تسمى هذه الدول حالات المادة الكلية .
في الغازات، تكون المسافة بين الجزيئات أكبر بكثير من حجم الجزيئات. إذا لم يتداخل الغاز مع جدران الحاوية، فإن جزيئاته تتطاير.
في السوائل والمواد الصلبة، تكون الجزيئات قريبة من بعضها البعض، وبالتالي لا يمكنها التحرك بعيدًا عن بعضها البعض.
يسمى الانتقال من حالة التجميع إلى أخرى المرحلة الانتقالية .
يسمى تحول المادة من الحالة الصلبة إلى السائلة ذوبان ، ودرجة الحرارة التي يحدث عندها هذا نقطة الانصهار . يسمى تحول المادة من الحالة السائلة إلى الحالة الصلبة بلورة ، ودرجة الحرارة الانتقالية درجة حرارة التبلور .
تسمى كمية الحرارة المنطلقة أثناء تبلور الجسم أو التي يمتصها الجسم أثناء الذوبان لكل وحدة كتلة الجسم حرارة محددة للانصهار (التبلور) π:
أثناء التبلور، يتم إطلاق نفس كمية الحرارة التي يتم امتصاصها أثناء الذوبان.
يسمى تحول المادة من الحالة السائلة إلى الحالة الغازية تبخير . يسمى انتقال المادة من الحالة الغازية إلى الحالة السائلة تركيز . كمية الحرارة اللازمة للتبخير (المنطلقة أثناء التكثيف):
| س = م، |
يسمى التبخير الذي يحدث من سطح السائل تبخر . يمكن أن يحدث التبخر في أي درجة حرارة. يسمى انتقال السائل إلى بخار، والذي يحدث في كامل حجم الجسم الغليان ودرجة الحرارة التي يغلي عندها السائل نقطة الغليان .
أخيراً، تسامي هو انتقال المادة من الحالة الصلبة إلى الحالة الغازية مباشرة، متجاوزة المرحلة السائلة.
إذا ظلت المعلمات الأخرى للبيئة الخارجية (على وجه الخصوص، الضغط) ثابتة، فلن تتغير درجة حرارة الجسم أثناء عملية الذوبان (التبلور) والغليان.
إذا كان عدد الجزيئات الخارجة من السائل يساوي عدد الجزيئات العائدة إلى السائل، نقول إن التوازن الديناميكي قد حدث بين السائل وبخاره. يسمى البخار الذي يكون في حالة توازن ديناميكي مع سائله
: [في 30 مجلدا] / الفصل. إد. صباحا بروخوروف; 1969-1978، المجلد الأول).
حالات المادة الكلية(من اللات. aggrego- أضيف) - هذه حالات لنفس المادة في فترات (فترات) مختلفة من درجات الحرارة والضغوط.
تعتبر الحالات الإجمالية الغازي,سائلو صعب. وأبسط الأمثلة على وجود نفس المادة في هذه الحالات المجمعة الثلاث التي نلاحظها في الحياة اليومية هي الجليد والماء وبخار الماء. بخار الماء غير المرئي موجود دائمًا في الهواء من حولنا. يوجد الماء في درجات حرارة تتراوح من 0 درجة مئوية إلى 100 درجة مئوية، ويوجد الجليد في درجات حرارة أقل من 0 درجة مئوية. عند درجات حرارة أعلى من 100 درجة مئوية والضغط الجوي الطبيعي، توجد جزيئات الماء فقط في حالة غازية - في شكل بخار الماء. الماء والثلج وبخار الماء هم نفس المادة بالصيغة الكيميائية ح2س.
نلاحظ العديد من المواد في الحياة اليومية فقط في إحدى حالات التجميع. وبالتالي فإن الأكسجين الموجود في الهواء المحيط بنا هو غاز. ولكن عند درجة حرارة -193 درجة مئوية يتحول إلى سائل. ومن خلال تبريد هذا السائل إلى -219 درجة مئوية، نحصل على الأكسجين الصلب. على العكس من ذلك، الحديد يكون صلبا في الظروف العادية. ولكن عند درجة حرارة 1535 درجة مئوية، يذوب الحديد ويتحول إلى سائل. فوق الحديد المنصهر سيكون هناك بخار غاز من ذرات الحديد.
توجد حالات تجميع مختلفة لكل مادة. ولا تختلف هذه المواد في الجزيئات، بل في كيفية تواجد هذه الجزيئات وكيفية حركتها. يظهر في الشكل ترتيب جزيئات الماء في ثلاث حالات تجميع:
-الانتقال من حالة تجميع إلى أخرى.في ظل ظروف معينة، يمكن للمواد أن تتحول من حالة التجمع إلى أخرى. تظهر جميع التحولات الممكنة في الشكل:

في المجموع، هناك ست عمليات فيها التحولات الإجمالية للمادة. يسمى انتقال المادة من الحالة الصلبة (البلورية) إلى الحالة السائلة ذوبان بلورة، أو تصلب. مثال على الذوبان هو ذوبان الجليد، وتحدث العملية العكسية عندما يتجمد الماء.
يسمى تحول المادة من الحالة السائلة إلى الحالة الغازية تبخير، تسمى العملية العكسية تركيز. ومن أمثلة التبخر تبخر الماء، ويمكن ملاحظة العملية العكسية عند سقوط الندى.
يسمى انتقال المادة من الحالة الصلبة مباشرة إلى الحالة الغازية (تجاوز الحالة السائلة). تسامي، أو تسامي، تسمى العملية العكسية إزالة التسامي. على سبيل المثال، يمكن تسخين الجرافيت إلى ألف وألفين وحتى ثلاثة آلاف درجة، ومع ذلك، لن يتحول إلى سائل: سوف يتسامى، أي أنه سينتقل على الفور من الحالة الصلبة إلى الحالة الغازية. ويمر أيضًا ما يسمى بالثلج الجاف (أول أكسيد الكربون الصلب) مباشرة إلى الحالة الغازية (متجاوزًا الحالة السائلة). ثاني أكسيد الكربون 2)، والتي يمكن رؤيتها في حاويات شحن الآيس كريم. جميع الروائح التي تمتلكها المواد الصلبة (على سبيل المثال، النفثالين) تنتج أيضًا عن التسامي: عندما تتطاير الجزيئات من مادة صلبة، فإنها تشكل غازًا (أو بخارًا) فوقها له رائحة.
مثال على إزالة التسامي هو تكوين أنماط من بلورات الجليد على النوافذ في الشتاء. تتشكل هذه الأنماط الجميلة عن طريق إزالة التسامي من بخار الماء في الهواء.
تلعب انتقالات المادة من حالة تجمع إلى أخرى دورًا مهمًا ليس فقط في الطبيعة، ولكن أيضًا في التكنولوجيا. وبالتالي، يمكن استخدام الماء المتحول إلى بخار في التوربينات البخارية في محطات توليد الطاقة. يتم الحصول على سبائك مختلفة من المعادن المنصهرة في المصانع: الفولاذ، الحديد الزهر، النحاس، إلخ. لفهم هذه العمليات، عليك أن تعرف ماذا يحدث للمادة عندما تتغير حالة التجميع وتحت أي ظروف يكون هذا التغيير ممكنًا.